
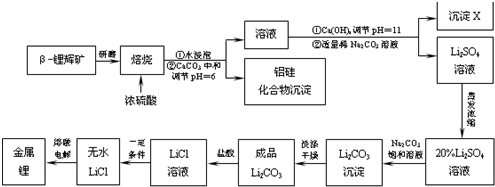
分析 工业上用硫酸与β-锂辉矿反应,生成不溶于酸的硅化合物和含少量铝、钙、镁离子的硫酸锂溶液,然后加入氢氧化钙和碳酸钠溶液除去滤液中的铝、钙、镁离子,得到较为纯净的硫酸锂,再将溶液中锂离子转化为溶解度较小碳酸锂,加饱和Na2CO3溶液的目的是使Li+转化生成Li2CO3沉淀,通过恰当方法最终得到单质锂.
(1)将硅酸盐写成二氧化硅和其它氧化物形式,照例而行,保证原子总数,化合价不变,按化合价分别写化学式,如有多个原子,在前面加上系数,使之成为倍数;
(2)溶液中含有镁离子;
(3)盐酸与Li2CO3反应生成氯化锂,水和二氧化碳;
(4)电解时阴极得电子;
(5)第一次用碳酸钠是调节pH值,第二次用碳酸钠是为了沉淀Li2CO3;
(6)氢化锂具有还原性,可与水发生氧化还原反应生成氢气;
(7)LiCl溶液加热蒸干,LiCl水解生成的LiOH,受热分解产生Li2O,电解Li2O的熔融物得到氧气.
解答 解:(1)LiAlSi2O6可表示为:Li2O•Al2O3•4SiO2,故答案为:Li2O•Al2O3•4SiO2;
(2)溶液中含有镁离子,氢氧化镁是沉淀,故答案为:Mg(OH)2;
(3)盐酸与Li2CO3反应的离子方程式Li2CO3+2H+=2Li++H2O+CO2↑,故答案为:Li2CO3+2H+=2Li++H2O+CO2↑;
(4)电解时阴极得电子,电极方程式为Li++e-=Li,故答案为:Li++e-=Li;
(5)碳酸钠可与酸反应,第一次用碳酸钠可起到调节pH值的作用,可沉淀氢氧化镁,第二次用碳酸钠时浓度较大,是为了沉淀Li2CO3,
故答案为:浓度过大会使部分Li+ 沉淀;此时浓度大则有利于Li2CO3沉淀的生成;
(6)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体,是氢化锂和水反应生成氢气和氢氧化锂,反应的化学方程式为:LiH+H2O=LiOH+H2↑,故答案为:LiH+H2O=LiOH+H2↑;
(7)LiCl溶液在加热易发生水解生成LiOH和HCl,LiCl溶液加热蒸干,LiCl水解生成LiOH,受热分解产生Li2O,实际上电解的是LiCl和Li2O的熔融混合物,电解时产生O2.
故答案为:加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解产生Li2O,电解时产生O2.
点评 本题主要考查物质的制备,为高考常见题型,侧重于学生的分析能力、实验能力的考查,题目涉及物质的分离、电解原理、盐类的水解等,难度难度较大,掌握实验的原理和流程分析是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.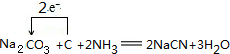 .
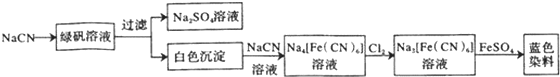
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
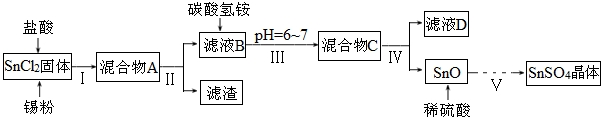
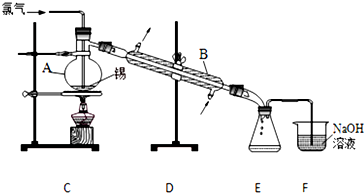
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
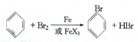
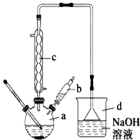 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(待测液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.95 | 15.20 | 15.15 | 16.95 |
| V(NaOH)/mL(消耗) | 14.95 | 15.00 | 15.05 | 16.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x的值.该组同学通过查阅资料查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
某化学学习小组的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x的值.该组同学通过查阅资料查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| C. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-数为NA | |
| D. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com