
【题目】下列有机物说法不正确的是( )
A.BrCH2CHBrCH2Br的名称为三溴丙烷
B.萘环![]() 上的一个H原子被一C4H9取代后的产物共有8种
上的一个H原子被一C4H9取代后的产物共有8种
C.对甲基苯乙烯中最多有17个原子共面
D.立方烷 一氯代物1种、二氯代物有3种、三氯代物也有3种
一氯代物1种、二氯代物有3种、三氯代物也有3种
【答案】A
【解析】
A:![]() 分别在1、2、3号C上,则
分别在1、2、3号C上,则![]() 的名称为1,2,
的名称为1,2,![]() 三溴丙烷,故A错误;
三溴丙烷,故A错误;
B.萘环上有2种H,![]() 有4种,则取代后的产物共有
有4种,则取代后的产物共有![]() 种,故B正确;
种,故B正确;
C.对甲基苯乙烯中,只有甲基上2个H与其它原子不共面,则最多有17个原子共面,故C正确;
D.立方烷结构对称,只有一种H,则一氧代物有1种,立方烷二氯代物有3种:两个氯原子在立方体同边有一种情况,两个氯原子的位置在对角有两种情况,立方烷三氯代物有3种:三个氯原子在同一个面上有一种情况,三个氯原子不在同一个面上有二种情况,情况1,2个氯原子在立方烷的棱上,另1个氯原子在对角线上,情况2,三个氯原子构成正三角形,所以同分异构体有三种,故D正确;
故答案选:A。


科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A.由图甲知,A点SO2的平衡浓度为0.08mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达到平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50MPa时不同温度下SO2的转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是___。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下移动
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=__(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置制取氯气。下列说法正确的是

A.该装置图中至少存在三处明显错误
B.该实验中收集氯气的方法不正确
C.如果需要得到干燥纯净的Cl2,只需在气体发生装置和收集装置之间连接一个装有浓硫酸的洗气瓶即可
D.含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将氨水滴入到FeCl3溶液中:Fe3++3OH-=Fe(OH)3↓
B.铜片跟氯化铁溶液反应: 2Fe3++3Cu=3Cu2++2Fe
C.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O
D.向FeCl3溶液中加入铁粉:Fe+2Fe3+=3Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Pd/A12O3是常见的汽车尾气催化剂。一种从废Pd/A12O3纳米催化剂(主要成分及含量:Pd0.3%,γ-A12O392.8%,其他杂质6.0%)中回收金属Pd的工艺:

已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是_________。
(2)“酸浸”时,Pd转化为PdCl42-,其离子方程式为_________。
(3)“滤液①”和“滤液②”中都含有的主要溶质有_________(填化学式)。
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是_________。两者相比,_________(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为_________。
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的_________极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成_________填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:
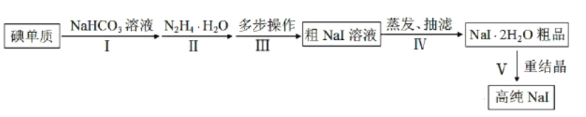
已知:
①I2(s)+I-(aq)![]() I
I![]() (aq)。
(aq)。
②水合肼(N2H4H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO![]() 离子。
离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为__。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是__。
(2)步骤Ⅱ,水合肼与IO-反应的离子方程式为__。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH值时依次加入的试剂为__。
A.NaOH B.HI C.NH3H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有__。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为__。
(5)将制备的NaI2H2O粗品以95%乙醇为溶剂进行重结晶。请给出合理的操作排序__。
加热95%乙醇→____→___→___→____→纯品(选填序号)。
①减压蒸发结晶 ②NaI2H2O粗品溶解 ③趁热过滤 ④真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的常用试剂是___,证明Fe3+存在的现象是____,配制含Fe2+的溶液时,常常向溶液中加入少量___,使被氧气氧化形成的Fe3+还原为Fe2+。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:___。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
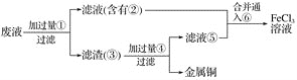
A.请写出上述实验中加入或生成的有关物质的化学式。
①___,②___,③___,④____,⑤____,⑥_____。
B.请写出相关反应的化学方程式。_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com