
【题目】Pd/A12O3是常见的汽车尾气催化剂。一种从废Pd/A12O3纳米催化剂(主要成分及含量:Pd0.3%,γ-A12O392.8%,其他杂质6.0%)中回收金属Pd的工艺:

已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是_________。
(2)“酸浸”时,Pd转化为PdCl42-,其离子方程式为_________。
(3)“滤液①”和“滤液②”中都含有的主要溶质有_________(填化学式)。
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是_________。两者相比,_________(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为_________。
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的_________极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成_________填化学式)。
【答案】有利于Pd与Al2O3的分离 3Pd+ClO3-+6H++11Cl=3PdCl42-+3H2O AlCl3 对环境产生较大污染(或耗酸量大、或腐蚀性强、或氧化效率低) NaClO3 [Pd(NH3)4]Cl2+2HCl=[Pd(NH3)2]Cl2↓+2NH4Cl 负 H2
【解析】
废Pd/A12O3纳米催化剂(主要成分及含量:Pd 0.3%,γ-A12O3 92.8%,其他杂质6.0%)进行预处理,废催化剂进行焙烧,使大量的γ-A12O3经焙烧转化为α-A12O3,处理后,加入足量盐酸和NaClO3进行酸浸和氧化处理,Pd转化为PdCl42-,γ-A12O3转化为Al3+后过滤,发生的离子反应为:3Pd+ClO3-+6H++11Cl=3PdCl42-+3H2O,A12O3+6H+=2Al3++ 3H2O,α-A12O3不与酸反应,对酸浸后的溶液过滤,α-A12O3以滤渣的形式除去,得到含有PdCl42-、Al3+的滤液,向滤液中加入过量的Al单质,将PdCl42-置换为Pb单质,在进行过滤,得到主要含有Al3+、Cl-的滤液①,得到的固体主要含有Pb和过量的Al单质,再加入盐酸将过量的单质Al除去,再次过滤,得到主要含有Al3+、Cl-、H+的滤液②和粗Pd,向粗Pd中再次加入盐酸和NaClO3,将Pd溶解转化为PdCl42-,向得到的溶液中加入氨水,将PdCl42-转化为[Pd(NH3)4]2+,再加入盐酸,使[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,过滤后,对[Pd(NH3)2]Cl2进行焙烧生成高纯度的Pd单质,据此分析解答。
(1)由于α-A12O3不与酸反应,“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是将大量的A12O3在酸浸时以沉淀的形式除去,有利于Pd与Al2O3的分离;
(2)根据分析,“酸浸”时,Pd转化为PdCl42-,其离子方程式为3Pd+ClO3-+6H++11Cl=3PdCl42-+3H2O;
(3)根据分析“滤液①”主要含有Al3+、Cl-,“滤液②”中主要含有Al3+、Cl-、H+,二者都含有的主要溶质有AlCl3;
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是使用硝酸作氧化剂会生成氮氧化物,对环境产生较大污染(或耗酸量大、或腐蚀性强、或氧化效率低);63g硝酸为1mol做氧化剂转化为二氧化氮,转移1mol电子,即1g硝酸参与反应得到![]() mol≈0.016mol的电子,106.5g NaClO3为1mol,做氧化剂转化为PdCl42-,转移6mol电子,即1g NaClO3参与反应得到
mol≈0.016mol的电子,106.5g NaClO3为1mol,做氧化剂转化为PdCl42-,转移6mol电子,即1g NaClO3参与反应得到![]() mol≈0.056mol电子,两者相比,NaClO3的氧化效率更高。
mol≈0.056mol电子,两者相比,NaClO3的氧化效率更高。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为[Pd(NH3)4]Cl2+2HCl=[Pd(NH3)2]Cl2↓+2NH4Cl;
(6) ①BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-,溴元素的化合价降低,得电子,发生还原反应,负载Pd/A12O3纳米催化剂的电极作阴极,电解池的阴极与电源的负极相连;
②电流密度越大,电催化效率越高;酸性条件下,但当电流密度过大时,进入到阴极的电子过多,多余的电子来不及被BrO3-得到转化为Br-,电解质溶液中的氢离子会结合多余的电子,则出现电极副反应:H++2e-=H2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是
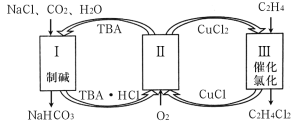
A.过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了TBA、CuCl2的再生
C.理论上每生成1mol NaHCO3,可得到1mol C2H4Cl2
D.过程Ⅲ中的反应是C2H4+2CuCl2![]() C2H4Cl2+2CuCl
C2H4Cl2+2CuCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成强效降血脂药物(G)的“片段”如下:
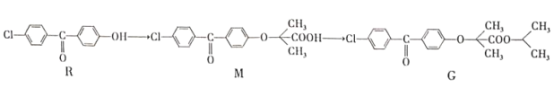
下列说法正确的是
A.R、M、G都能发生加成、取代反应B.R、M、G都有3种含氧官能团
C.M分子中所有碳原子可能共平面D.G分子中苯环上二溴代物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物说法不正确的是( )
A.BrCH2CHBrCH2Br的名称为三溴丙烷
B.萘环![]() 上的一个H原子被一C4H9取代后的产物共有8种
上的一个H原子被一C4H9取代后的产物共有8种
C.对甲基苯乙烯中最多有17个原子共面
D.立方烷 一氯代物1种、二氯代物有3种、三氯代物也有3种
一氯代物1种、二氯代物有3种、三氯代物也有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,化合物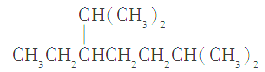 的名称为2,6二甲基-5-乙基庚烷
的名称为2,6二甲基-5-乙基庚烷
B.丙氨酸和苯丙氨酸脱水,最多可生成3种二肽
C.化合物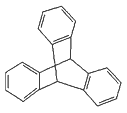 是苯的同系物
是苯的同系物
D.三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属与硝酸的反应,实验如下。
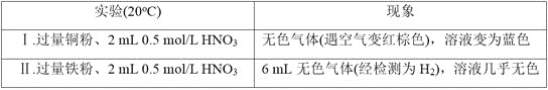
(1)Ⅰ中的无色气体是_________。
(2)Ⅱ中生成H2的离子方程式是______________。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于![]() ,所以
,所以![]() 没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
②乙同学通过分析,推测出![]() 也能被还原,依据是_____________,进而他通过实验证实该溶液中含有
也能被还原,依据是_____________,进而他通过实验证实该溶液中含有![]() ,其实验操作是____________。
,其实验操作是____________。
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有__________;试推测还可能有哪些因素影响_________(列举1条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如图所示:
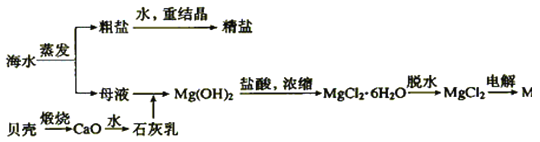
(1)写出下列反应的化学方程式。
①石灰乳与母液反应___;
②Mg(OH)2中加入盐酸的离子方程式:__;
③MgCl2![]() Mg:___。
Mg:___。
(2)在海水提取镁的过程中,没有涉及的化学反应类型__
A.分解反应 B.化合反应 C.复分解反应 D.置换反应 E.氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、P、As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
(1)意大利罗马大学的Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为______________________,N—N键的键角为______________________;
(2)基态砷原子的价电子排布图为______________________,砷与同周期相邻元素的第一电离能由大到小的顺序为______________________;
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是____________________(填“PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是____________________;S—Cl键键长 ______P-Cl键键长(填“>”、“=”或“<”),原因是____________________。
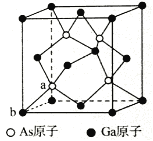
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为____________________。若该晶体的密度为ρg/cm3,设NA为阿伏加德罗常数的值,则a、b的距离为_________pm(用含ρ和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,0.1mol·L-1某一元酸(HA)溶液中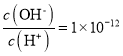 ,加入少量NaA晶体或加水稀释,溶液中c(OH-)均增大
,加入少量NaA晶体或加水稀释,溶液中c(OH-)均增大
B.已知:0.1mol·L-1KHC2O4溶液呈酸性,则存在关系:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)>c(H+)>c(OH-)
C.25℃,H2SO3![]() HSO3—+H+的电离常数Ka=1×10-2mol·L-1,该温度下NaHSO3水解反应的平衡常数Kh=1×10-12mol·L-1
HSO3—+H+的电离常数Ka=1×10-2mol·L-1,该温度下NaHSO3水解反应的平衡常数Kh=1×10-12mol·L-1
D.0.1mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com