
【题目】研究金属与硝酸的反应,实验如下。
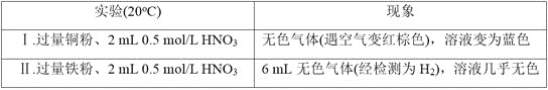
(1)Ⅰ中的无色气体是_________。
(2)Ⅱ中生成H2的离子方程式是______________。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于![]() ,所以
,所以![]() 没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
②乙同学通过分析,推测出![]() 也能被还原,依据是_____________,进而他通过实验证实该溶液中含有
也能被还原,依据是_____________,进而他通过实验证实该溶液中含有![]() ,其实验操作是____________。
,其实验操作是____________。
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有__________;试推测还可能有哪些因素影响_________(列举1条)。
【答案】NO或一氧化氮 Fe+2H+=Fe2++H2↑ 硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出 ![]() 中氮元素的化合价为最高价,具有氧化性 取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体 金属的种类、硝酸的浓度 温度
中氮元素的化合价为最高价,具有氧化性 取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体 金属的种类、硝酸的浓度 温度
【解析】
(1)铜与硝酸反应生成无色气体为一氧化氮;
(2)Ⅱ中铁与溶液中的氢离子发生氧化还原反应生成H2;
(3)①如硝酸根离子没有发生反应,则Ⅰ溶液不会变蓝,溶液变蓝说明铜被氧化;
②元素化合价处于最高价具有氧化性,铵根离子的检验可以加强碱并加热,产生的气体通过湿润红色石蕊试纸;
(4)金属与硝酸反应时,影响硝酸还原产物不同的因素金属的活泼性,硝酸的浓度和温度
(1)铜与硝酸反应生成无色气体为一氧化氮,遇空气变红棕色二氧化氮;
(2)Ⅱ中铁与溶液中的氢离子发生氧化还原反应生成H2,离子反应方程式为:Fe+2H+===Fe2++H2↑;
(3)①如硝酸根离子没有发生反应,则Ⅰ溶液不会变蓝,溶液变蓝说明铜被氧化,其实验证据是硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出;
②元素化合价处于最高价具有氧化性,NO中氮元素的化合价为最高价,具有氧化性,被还原,铵根离子的检验可以加强碱并加热,产生的气体通过湿润红色石蕊试纸,所以具体操作为:取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体;
(4)金属与硝酸反应时,影响硝酸还原产物不同的因素有金属的活泼性,硝酸的浓度和温度。


科目:高中化学 来源: 题型:
【题目】铝和氢氧化钠都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是___________________________________________。
(2)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如左下图所示。
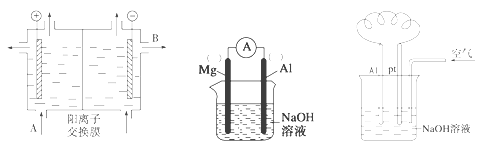
①请写出A、B两处物质的名称或化学式:A___________________、B____________________
②请写出电解食盐水的离子方程式__________________________________________
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如上中图。
①负极材料为________(填Mg或Al)。
②该原电池的总反应式为____________________________________________
(4)铝—空气燃料电池可用于电动汽车,通常以NaOH溶液为电解液,铝合金为负极,通入空气的极为正极(如右上图),则
负极的电极反应式为__________________________________;
正极的电极反应式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是___。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下移动
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=__(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将氨水滴入到FeCl3溶液中:Fe3++3OH-=Fe(OH)3↓
B.铜片跟氯化铁溶液反应: 2Fe3++3Cu=3Cu2++2Fe
C.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O
D.向FeCl3溶液中加入铁粉:Fe+2Fe3+=3Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Pd/A12O3是常见的汽车尾气催化剂。一种从废Pd/A12O3纳米催化剂(主要成分及含量:Pd0.3%,γ-A12O392.8%,其他杂质6.0%)中回收金属Pd的工艺:

已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是_________。
(2)“酸浸”时,Pd转化为PdCl42-,其离子方程式为_________。
(3)“滤液①”和“滤液②”中都含有的主要溶质有_________(填化学式)。
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是_________。两者相比,_________(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为_________。
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的_________极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成_________填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月,科学家报道了利用磁性纳米Fe3O4颗粒除去水体草甘膦污染物的方法,其原理如图所示:(Fe3O4颗粒在水中表面会带—OH,在水体pH≈4时除污效果最好)。下列说法不正确的是( )
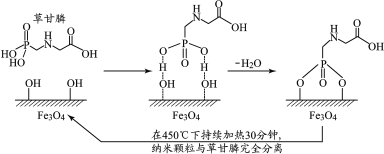
A.草甘膦既可以和盐酸反应,又可以和氢氧化钠溶液反应
B.Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂
C.Fe3O4纳米颗粒粒径越小、溶液中c(OH)越大除污效果越好
D.处理完成后,Fe3O4纳米颗粒可利用磁铁回收,经加热活化重复使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:
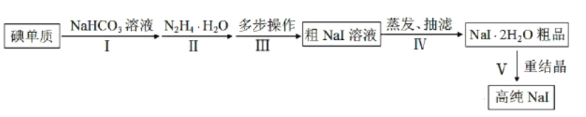
已知:
①I2(s)+I-(aq)![]() I
I![]() (aq)。
(aq)。
②水合肼(N2H4H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO![]() 离子。
离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为__。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是__。
(2)步骤Ⅱ,水合肼与IO-反应的离子方程式为__。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH值时依次加入的试剂为__。
A.NaOH B.HI C.NH3H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有__。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为__。
(5)将制备的NaI2H2O粗品以95%乙醇为溶剂进行重结晶。请给出合理的操作排序__。
加热95%乙醇→____→___→___→____→纯品(选填序号)。
①减压蒸发结晶 ②NaI2H2O粗品溶解 ③趁热过滤 ④真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为_____。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是_____(填元素符号)。
(3)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(4)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____ (“减弱”或“不变”)。铁晶体中粒子之间作用力类型是_____。
(5)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_____;
②CH4和HCHO比较,键角较大的是_____,主要原因是_____。
(6)钴晶胞和白铜(铜镍合金)晶胞分别如图1、2所示。
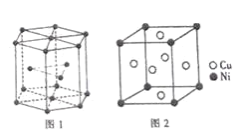
①钴晶胞堆积方式的名称为_____;
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____ pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10.00mL0.1000mol·L-1HCl和0.1000mol·L-1CH3COOH的混合溶液中滴入0.1000mol·L-1NaOH溶液,溶液pH的变化曲线如图所示。已知:常温下,Ka(CH3COOH)=1.75×10-5。下列叙述错误的是
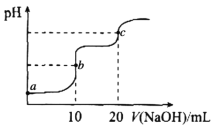
A.a点所示溶液中,CH3COOH的电离度约为1.75×10-2%
B.a、b、c三点所示溶液中,水的电离程度最大的是c点
C.c点所示溶液中:c(Na+)>c(C1-)>c(CH3COOH>c(OH-)>c(H+)
D.加热b点所示溶液,![]() 的值减小
的值减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com