
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为_____。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是_____(填元素符号)。
(3)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(4)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____ (“减弱”或“不变”)。铁晶体中粒子之间作用力类型是_____。
(5)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_____;
②CH4和HCHO比较,键角较大的是_____,主要原因是_____。
(6)钴晶胞和白铜(铜镍合金)晶胞分别如图1、2所示。
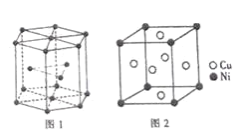
①钴晶胞堆积方式的名称为_____;
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____ pm(列出计算式)。
【答案】3d104s1 Cr 光谱分析 减弱 金属键 HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强 HCHO CH4中C原子采取sp3杂化,HCHO中C原子采取sp2杂化 六方最密堆积 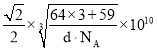
【解析】
(1)具有全充满、半充满、全空的电子构型的原子更稳定;
(2)在3d过渡金属中,基态原子未成对电子数最多的元素的价电子排布式为3d54s1;
(3)用原子光谱上的特征谱线来鉴定元素称为光谱分析;
(4)石墨烯限域单原子铁活化CH4分子中的C-H键,说明在催化剂条件下C-H更容易发生断裂,其键能降低;铁晶体属于金属晶体,晶体中存在自由电子和金属阳离子,靠金属键结合形成金属单质;
(5)①HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强;
②CH4为正四面体构型,HCHO为平面三角形,键角主要由碳原子杂化方式决定;
(6)①由图1所示,可知钴晶胞的堆积方式是六方最密堆积;
②面心6个Cu原子构成正八面体,棱上2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长即为两个面心上铜原子最短核间距,由几何知识可知两个面心上铜原子最短核间距=直角边长度的![]() 倍,而等腰直角三角形的直角边长等于晶胞棱长的
倍,而等腰直角三角形的直角边长等于晶胞棱长的![]() ,均摊法计算晶胞中Cu、Ni原子数目,计算晶胞质量,结合晶胞质量=晶体密度×晶胞体积计算晶胞棱长。
,均摊法计算晶胞中Cu、Ni原子数目,计算晶胞质量,结合晶胞质量=晶体密度×晶胞体积计算晶胞棱长。
(1)具有全充满、半充满、全空的电子构型的原子更稳定,在Mn、Fe、Co、Ni、Cu的外围电子排布式分别为3d54s2、3d64s2、3d74s2、3d84s2、3d104s1,某基态原子Cu原子核外电子排布遵循“洪特规则特例”;
(2)在3d过渡金属中,基态原子未成对电子数最多的元素的价电子排布式为3d54s1,该元素为Cr;
(3)用原子光谱上的特征谱线来鉴定元素称为光谱分析;
(4)石墨烯限域单原子铁活化CH4分子中的C-H键,说明在催化剂条件下C-H更容易发生断裂,其键能降低,即导致C与H之间的作用力减弱;铁晶体属于金属晶体,晶体中存在自由电子和金属阳离子,靠金属键结合形成金属单质;
(5)①HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强,故沸点HCOOH>CH3OH>HCHO;
②CH4中C原子采取sp3杂化,为正四面体构型,HCHO中C原子采取sp2杂化,为平面三角形,HCHO中键角较大;
(6)①由图1所示,可知钴晶胞的堆积方式是六方最密堆积;
②面心6个Cu原子构成正八面体,棱上2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长即为两个面心上铜原子最短核间距,由几何知识可知两个面心上铜原子最短核间距=直角边长度的![]() 倍,而等腰直角三角形的直角边长等于晶胞棱长的
倍,而等腰直角三角形的直角边长等于晶胞棱长的![]() ,晶胞中Cu=6×
,晶胞中Cu=6×![]() =3、Ni原子数目=8×
=3、Ni原子数目=8×![]() =1,晶胞质量=
=1,晶胞质量=![]() g,设晶胞棱长为 a pm,则:dgcm-3×(a×10-10 cm)3=
g,设晶胞棱长为 a pm,则:dgcm-3×(a×10-10 cm)3=![]() g,解得a=
g,解得a=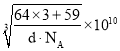 ,故两个面心上铜原子最短核间距=
,故两个面心上铜原子最短核间距=![]() ×(
×(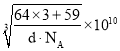 pm×
pm×![]() )=
)=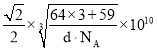 pm。
pm。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】研究金属与硝酸的反应,实验如下。
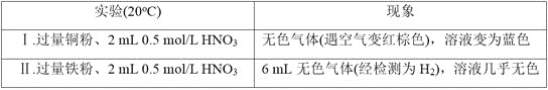
(1)Ⅰ中的无色气体是_________。
(2)Ⅱ中生成H2的离子方程式是______________。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于![]() ,所以
,所以![]() 没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________。
②乙同学通过分析,推测出![]() 也能被还原,依据是_____________,进而他通过实验证实该溶液中含有
也能被还原,依据是_____________,进而他通过实验证实该溶液中含有![]() ,其实验操作是____________。
,其实验操作是____________。
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有__________;试推测还可能有哪些因素影响_________(列举1条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:
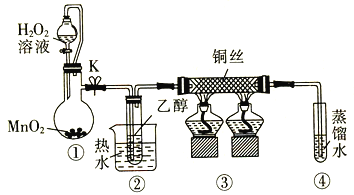
下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、P、As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
(1)意大利罗马大学的Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为______________________,N—N键的键角为______________________;
(2)基态砷原子的价电子排布图为______________________,砷与同周期相邻元素的第一电离能由大到小的顺序为______________________;
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是____________________(填“PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是____________________;S—Cl键键长 ______P-Cl键键长(填“>”、“=”或“<”),原因是____________________。
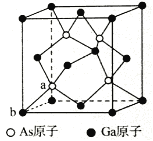
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为____________________。若该晶体的密度为ρg/cm3,设NA为阿伏加德罗常数的值,则a、b的距离为_________pm(用含ρ和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用下列装置完成了探究浓硫酸和 SO2性质的实验(部分夹持装置已省略),下列“ 现象预测” 与“ 解释或结论” 均正确的是
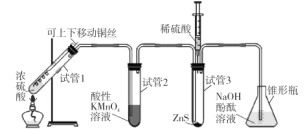
选项 | 仪器 | 现象预测 | 解释或结论 |
A | 试管1 | 有气泡、酸雾,溶液中有白色固体出现 | 酸雾是SO2所形成,白色固体是硫酸铜晶体 |
B | 试管2 | 紫红色溶液由深变浅,直至褪色 | SO2具有还原性 |
C | 试管3 | 注入稀硫酸后,没有现象 | 由于Ksp(ZnS)太小,SO2与ZnS在注入稀硫酸后仍不反应 |
D | 锥形瓶 | 溶液红色变浅 | NaOH溶液完全转化为NaHSO3溶液,NaHSO3溶液碱性小于NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、F均是常见元素组成的单质,B是淡黄色固体,常温下C是液体。
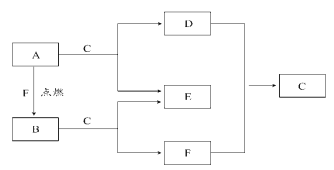
请回答下列问题:
(1)B和E的化学式:B__,E___。
(2)A与C反应的离子方程式为___;A与F生成B的化学方程式为___。
(3)关于A的叙述中正确的是___(填序号)。
①A有很强的还原性 ②A的焰色反应呈紫色
③少量A可以保存在冷水里 ④A着火时应用细沙盖灭
(4)将A、镁、铝各0.3mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体体积之比是__。
①1∶2∶3 ②6∶3∶2 ③3∶1∶1 ④1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯二氮卓类药物氟马西尼(F)的合成路线如下图所示。请回答下列问题:
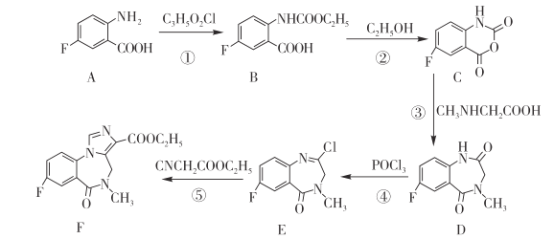
(1)A中官能团有氟原子、_____和________。(均填名称)
(2)C3H5O2Cl的结构式为________。
(3)反应①和②的反应类型相同,其反应类型是___________。
(4)化合物 D的分子式为___________。
(5)反应⑤生成“ 物质 F” 和 HCl,则 E→F的化学反应方程式为________。
(6)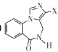 是 F的同分异构体,其中 X部分含—COOH且没有支链,满足该条件的同分异构体有______种(不考虑立体异构)。
是 F的同分异构体,其中 X部分含—COOH且没有支链,满足该条件的同分异构体有______种(不考虑立体异构)。
(7)已知氨基酸之间脱水能够形成含肽键的化合物,请设计由甘氨酸(HOOCCH2NH2)和CNCH2COOC2H5制备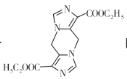 的合成路线________(无机试剂任选)。
的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是
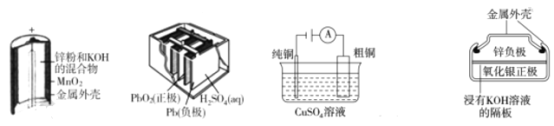
A.图(a)中,MnO2的作用是催化剂
B.图(b)所示电池放电过程中,两极板的质量不断增大
C.图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图(d)所示电池充电过程中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com