
【题目】(1)按系统命名法命名![]() __。
__。
(2)2,6-二甲基-4-乙基辛烷分子式是__,1mol该烃完全燃烧需消耗氧气__mol。
科目:高中化学 来源: 题型:
【题目】实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料α-Fe2O3。
其主要实验流程如下:
![]()
(1)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有___________(填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成___________(填化学式);检验Fe3+是否还原完全的实验操作是______________。
(3)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是___________[![]() ,
,![]() ]。
]。
(4)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为____________。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:__。
(FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钠都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是___________________________________________。
(2)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如左下图所示。
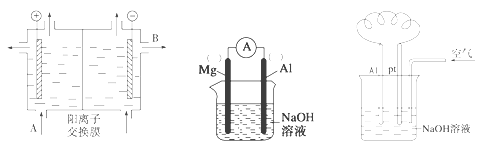
①请写出A、B两处物质的名称或化学式:A___________________、B____________________
②请写出电解食盐水的离子方程式__________________________________________
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如上中图。
①负极材料为________(填Mg或Al)。
②该原电池的总反应式为____________________________________________
(4)铝—空气燃料电池可用于电动汽车,通常以NaOH溶液为电解液,铝合金为负极,通入空气的极为正极(如右上图),则
负极的电极反应式为__________________________________;
正极的电极反应式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和实验现象得出的结论中正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向5 mL0.1 mol/LKI溶液中加入0.1 mol/LFeCl3溶液10 mL,振荡,用苯萃取数次后取下层溶液,滴加5滴KSCN溶液 | 出现红色 | Fe3+与I-之间的反应是有一定限度的 |
B | 将己烯加入溴水中,振荡、静置,测溴水层溶液前后的pH | 溶液pH增大 | 说明己烯发生加成反应,不是取代反应 |
C | 用pH计分别测定饱和SO2溶液和饱和CO2溶液的pH | 饱和SO2溶液的pH小 | 酸性:H2SO3>H2CO3 |
D | 向酸性高锰酸钾溶液中滴加甲苯 | 溶液褪色 | 甲基对苯环产生影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A.由图甲知,A点SO2的平衡浓度为0.08mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达到平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50MPa时不同温度下SO2的转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
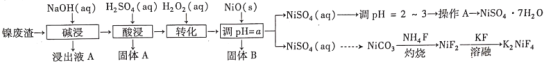
【题目】“翠矾”(NiSO4·7H2O)在印染工业作媒染剂,生产酞菁艳蓝络合剂;氟镍化钾(K2NiF4)是结构化学研究的热点物质。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料合成“翠矾”和氟镍化钾的流程如下:
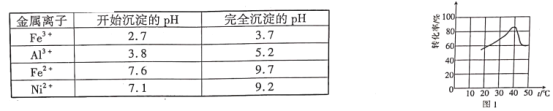
几种金属离子的氢氧化物沉淀pH如下:
请回答下列问题:
(1)翠矾、绿矾、明矾、蓝矾等“矾类”都含有______元素(填元素符号)。pH=a的范围为___________。
(2)“转化”过程中一定体积和浓度的双氧水,“转化率”与温度关系如图1所示。温度高于40℃,转化率急速降低的原因可能是______。空气可以替代双氧水,空气的作用是______(用离子方程式表示)。
(3)NiSO4和NH4HCO3溶液生成NiCO3,其离子方程式为___________。
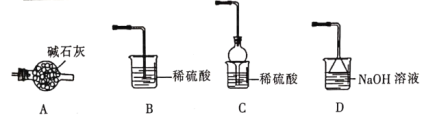
(4)灼烧NiCO3和NH4F以物质的量之比为1:1组成的混合物时,为避免污染环境,选择下列装置吸收尾气,最宜选择___________。(填选项)
(5)已知常温下,Ksp(NiCO3)=1.42×10-7。分离NiCO3时滤液中c(Ni2+)≤1.0×10-5 mol·L-1时,c(CO![]() )≥___________mol·L-1。
)≥___________mol·L-1。
(6)准确称取ω g翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250 mL溶液,取20.00 mL所配溶液于锥形瓶,用c mol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02 mL、19.98 mL、19.50 mL,则翠矾的纯度为___________%(只列计算式,不考虑杂质反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是___。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下移动
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=__(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将氨水滴入到FeCl3溶液中:Fe3++3OH-=Fe(OH)3↓
B.铜片跟氯化铁溶液反应: 2Fe3++3Cu=3Cu2++2Fe
C.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O
D.向FeCl3溶液中加入铁粉:Fe+2Fe3+=3Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为_____。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是_____(填元素符号)。
(3)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(4)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____ (“减弱”或“不变”)。铁晶体中粒子之间作用力类型是_____。
(5)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_____;
②CH4和HCHO比较,键角较大的是_____,主要原因是_____。
(6)钴晶胞和白铜(铜镍合金)晶胞分别如图1、2所示。
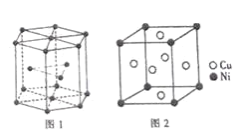
①钴晶胞堆积方式的名称为_____;
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____ pm(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com