
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是
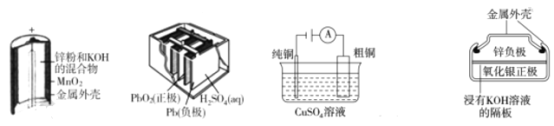
A.图(a)中,MnO2的作用是催化剂
B.图(b)所示电池放电过程中,两极板的质量不断增大
C.图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图(d)所示电池充电过程中,Ag2O是氧化剂,电池工作过程中还原为Ag
科目:高中化学 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为_____。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是_____(填元素符号)。
(3)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(4)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____ (“减弱”或“不变”)。铁晶体中粒子之间作用力类型是_____。
(5)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_____;
②CH4和HCHO比较,键角较大的是_____,主要原因是_____。
(6)钴晶胞和白铜(铜镍合金)晶胞分别如图1、2所示。
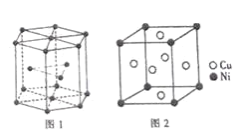
①钴晶胞堆积方式的名称为_____;
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____ pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10.00mL0.1000mol·L-1HCl和0.1000mol·L-1CH3COOH的混合溶液中滴入0.1000mol·L-1NaOH溶液,溶液pH的变化曲线如图所示。已知:常温下,Ka(CH3COOH)=1.75×10-5。下列叙述错误的是
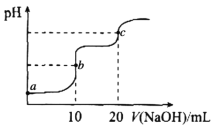
A.a点所示溶液中,CH3COOH的电离度约为1.75×10-2%
B.a、b、c三点所示溶液中,水的电离程度最大的是c点
C.c点所示溶液中:c(Na+)>c(C1-)>c(CH3COOH>c(OH-)>c(H+)
D.加热b点所示溶液,![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A. x≤a,2I+Cl2=I2+2Cl
B. x=1.2a,10Fe2++14I+12Cl2=10Fe3++7I2+24Cl
C. x=1.4a,4Fe2++10I+7Cl2=4Fe3++5I2+14Cl
D. x≥1.5a,2Fe2++4I+3Cl2=2Fe3++2I2+6Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达不正确的是
A.用SO2水溶液吸收Br2:SO2+Br2+2H2O=4H++SO42-+2Br-
B.酸性高锰酸钾和过氧化氢制取少量氧气:4MnO4-+4H2O2+12H+=4Mn2++7O2↑+10H2O
C.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O
D.少量Ba(HCO3)2溶液与NaOH溶液反应:Ba2++2HCO3-+2OH-=BaCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以铝土矿(含 Al2O3、Fe2O3和 SiO2)为原料进行炼铝探究(流程如下),叙述错误的是
![]()
A. 步骤①②过程中均需过滤操作
B. a、b中铝元素的化合价相同
C. 反应③的化学方程式为:2 NaAlO2+3H2O+CO2 = 2Al(OH)3↓+Na2CO3
D. d只能是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料。请用离子方程式来证明它是一种两性氧化物:____________、___________.
(2)取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的标准状况下H2体积分别为33.6L、22.4L则该合金中镁、铝的物质的量之比为___________。
(3)将一定质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示.则盐酸的物质的量浓度(假设反应前后溶液体积的变化忽略不计)_______________.产生沉淀质量的最大值_____________g.
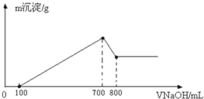
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象和结论都正确的是
实验 | 现象 | 结论 |
A.充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不能燃烧 | Na2SiO3可做防火剂 |
B.测定浓度均为0.1 mol·L-1的CH3COONa与HCOONa溶液的pH | CH3COONa溶液的pH较大 | 结合H+的能力: HCOO->CH3COO- |
C.某溶液中加浓NaOH溶液加热 | 产生能使湿润的蓝色石蕊试纸变红色的气体 | 原溶液中有 |
D.将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有CCl4、I2、I-等)中回收碘,向废液中加入Na2SO3溶液反应后进行分离除去CCl4,再向反应液中通入Cl2进行氧化、富集等系列操作获得碘单质。下列说法不正确的是:
A.加入Na2SO3溶液发生的氧化还原反应为:SO32-+I2+H2O=SO42-+2I-+2H+
B.氧化时应控制在较低温度(40℃左右),可增大Cl2的溶解度并减少I2的损失
C.分离除去CCl4的操作为萃取,应在分液漏斗中进行
D.工业上常在干海带浸泡液中通入适量氯气,再采用过滤的方法得到粗碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com