
【题目】下列实验的现象和结论都正确的是
实验 | 现象 | 结论 |
A.充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不能燃烧 | Na2SiO3可做防火剂 |
B.测定浓度均为0.1 mol·L-1的CH3COONa与HCOONa溶液的pH | CH3COONa溶液的pH较大 | 结合H+的能力: HCOO->CH3COO- |
C.某溶液中加浓NaOH溶液加热 | 产生能使湿润的蓝色石蕊试纸变红色的气体 | 原溶液中有 |
D.将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
A.AB.BC.CD.D
【答案】A
【解析】
A.浸泡了Na2SiO3饱和溶液的小木条,沥干后在酒精灯外焰加热,小木条不能燃烧,表明Na2SiO3能阻止小木条的燃烧,说明Na2SiO3熔点高,比较稳定,具有防火能力,可作防火剂,A正确;
B.根据“越弱越水解”的规律分析,浓度均为0.1 mol·L-1的CH3COONa与HCOONa溶液,前者的pH大,表明前者的水解能力强,则结合H+的能力CH3COO->HCOO-,B不正确;
C.某溶液中加浓NaOH溶液加热,产生能使湿润的红色石蕊试纸变蓝色的气体,则表明原溶液中有![]() ,C不正确;
,C不正确;
D.将SO2通入酸性高锰酸钾溶液中,溶液褪色,表明SO2具有还原性,而不是漂白性,D不正确;
故选A。


科目:高中化学 来源: 题型:
【题目】苯二氮卓类药物氟马西尼(F)的合成路线如下图所示。请回答下列问题:
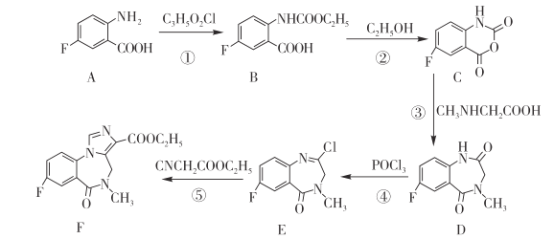
(1)A中官能团有氟原子、_____和________。(均填名称)
(2)C3H5O2Cl的结构式为________。
(3)反应①和②的反应类型相同,其反应类型是___________。
(4)化合物 D的分子式为___________。
(5)反应⑤生成“ 物质 F” 和 HCl,则 E→F的化学反应方程式为________。
(6)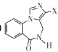 是 F的同分异构体,其中 X部分含—COOH且没有支链,满足该条件的同分异构体有______种(不考虑立体异构)。
是 F的同分异构体,其中 X部分含—COOH且没有支链,满足该条件的同分异构体有______种(不考虑立体异构)。
(7)已知氨基酸之间脱水能够形成含肽键的化合物,请设计由甘氨酸(HOOCCH2NH2)和CNCH2COOC2H5制备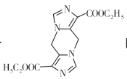 的合成路线________(无机试剂任选)。
的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是
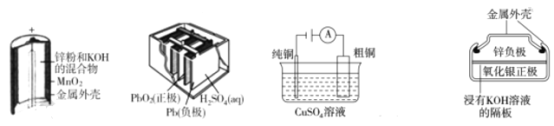
A.图(a)中,MnO2的作用是催化剂
B.图(b)所示电池放电过程中,两极板的质量不断增大
C.图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图(d)所示电池充电过程中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,发生_____(填“氧化”或“还原”)反应,则该反应的还原剂是________。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为____。
(3)根据上述反应可推知________(填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。_____________
![]() +
+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
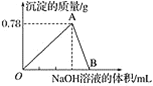
(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.向氨水中加入少量的硫酸氢钠,溶液碱性减弱
B.每升pH=3的H2C2O4 溶液中H+数目为0.003NA
C.常温下,CH3COONa溶液中加水,水电离产生的c(H+)、c(OH-)保持不变
D.0.1molFeCl3溶于水形成的Fe(OH)3胶体粒子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化碳主要用于医学研究及临床诊断及电子工业;含碳的有机物醇、醛在生产生活中有广泛运用。
I.(1)工业上用CO2和H2在一定条件下反应可合成二甲醚,已知:
2CO2(g)+6H2(g)=2CH3OH(g)+2H2O(g) △H1=-107.4kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2=-23.4kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=________kJ/mol
CH3OCH3(g)+3H2O(g) △H3=________kJ/mol
(2)在一定条件下将CO2和H2充入一固定容积的密闭容器中,在两种不同温度下发生反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
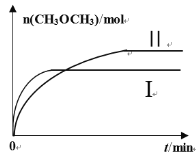
①曲线I、Ⅱ对应的平衡常数大小关系为KI_______KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是________(填序号)。
a.混合气体密度不变
b.二甲醚和水蒸气的反应速率之比保持不变
c.v正(H2)=2v逆(H2O)
d.2个C=O断裂的同时有3个H-O断裂
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
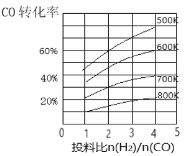
①600K温度下,将1molCO和4molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(H2)=___________。
②若投料比保持不变,升高温度,该反应平衡向_______方向移动(填“正反应”或“逆反应”)。
③上述合成甲醇的过程中提高CO的转化率可采取的措施有______。(列举一种即可)。
Ⅱ.用隔膜电解法处理高浓度乙醛废水的原理为:
使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极产生气体的电极反应为:______。
②在实际工艺处理过程中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为400mg/L的废水,可得到乙醇________kg(计算结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:![]()
![]()
![]()
![]()
若某反应的平衡常数表达式为![]() ,则此反应的热化学方程式为_______。
,则此反应的热化学方程式为_______。
(2)![]() 在一定条件下可发生分解:
在一定条件下可发生分解:![]() ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量![]() 进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
a. ![]() 和
和![]() 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c. ![]() d. 气体的密度保持不变
d. 气体的密度保持不变
(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(3)将![]() 和
和![]() 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成![]() ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下![]() 转化率随温度的变化关系。
转化率随温度的变化关系。
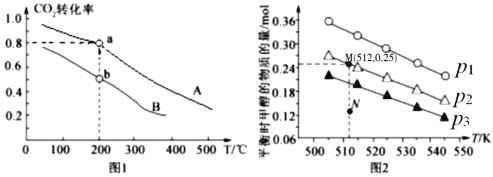
①a、b两点化学反应速率分别用![]() ,表示,则
,表示,则![]() _____
_____![]() (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②列出a点对应的平衡常数表达式K= ____________________。
(4)在1.0 L恒容密闭容器中投入1 mol ![]() 和2.75 mol
和2.75 mol ![]() 发生反应:
发生反应:![]() CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为![]()
D.在![]() 及512 K时,图中N点
及512 K时,图中N点![]()
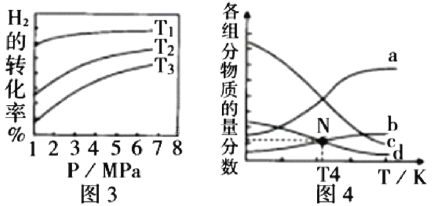
(5)![]() 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g) ![]() C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g) ![]() ;m代表起始时的投料比,即
;m代表起始时的投料比,即![]() 。
。
① 图3中投料比相同,温度![]() ,则该反应的焓变
,则该反应的焓变![]() _______0(填
_______0(填![]() )。
)。
② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式)。
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为 ______(填“阳膜”、“阴膜”),阳极的电极反应式为_______________________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有KL溶液的试管中加入少许![]() 后滴加氯水,
后滴加氯水,![]() 层变成紫色。如果继续向试管中滴加氯水,振荡,
层变成紫色。如果继续向试管中滴加氯水,振荡,![]() 层会逐渐变浅,最后变成无色。
层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平![]() 层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
 _____
_____
2)整个过程中的还原剂是___。
3)把KL换成KBr,则![]() 层变为__色:继续滴加氯水,
层变为__色:继续滴加氯水,![]() 层的颜色没有变化。
层的颜色没有变化。![]() 、
、![]() 、
、![]() 氧化性由强到弱的顺序是______。
氧化性由强到弱的顺序是______。
4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含![]() 的食盐)1000kg,若庄Kl与
的食盐)1000kg,若庄Kl与![]() 反应制
反应制![]() ,至少需要消耗
,至少需要消耗![]() ________L(标准状况,保留2位小数)。
________L(标准状况,保留2位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com