
【题目】含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A. x≤a,2I+Cl2=I2+2Cl
B. x=1.2a,10Fe2++14I+12Cl2=10Fe3++7I2+24Cl
C. x=1.4a,4Fe2++10I+7Cl2=4Fe3++5I2+14Cl
D. x≥1.5a,2Fe2++4I+3Cl2=2Fe3++2I2+6Cl
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:________________________。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式为__________________。
④当看到装置C中导管液面上升时应进行的操作是______________________。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______________________作指示剂,用0.1000mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2S2O32- = 2I- +S4O62-),当看到____________________________现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于图示四个装置的叙述不正确的是( )

A. 装置甲的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝
B. 装置乙可用于测定化学反应的反应热
C. 装置丙是可以在铁钉上镀铜的装置
D. 装置丁若为电解精炼铜装置,则X电极为精铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol·L-1的混合溶液,溶液中c(CO32-)、c(HCO3-)与pH的关系如图所示。下列说法中错误的是
(己知:CO32-+H2O![]() HCO3-+OH- K=2×10-4,1g5=0.7)
HCO3-+OH- K=2×10-4,1g5=0.7)
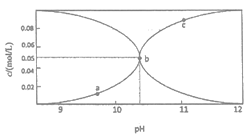
A. a点的溶液中:c(HCO3-)>c(H2CO3)+c(CO32-)
B. b点横坐标数值大约为10.3
C. c点的溶液中:c(Na+)<2c(CO32-)十c(HCO3-)
D. 溶液中水的电离程度:a<b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则剩余锌粉的质量为
A. 1.0g B. 2.0g C. 2.5g D. 3.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )

A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2
B.与途径①、③相比,途径②更好地体现了绿色化学思想
C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③
D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H=-57.4kJ/mol
D.己知C(s)+O2(g)═CO2(g)△H1,2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向xmL 0. 1 mol/L氨水中滴加等物质的量浓度的稀H2SO4 ,测得混合溶液的温度和pOH[pOH==-lg c(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化)。下列说法不正确的是

A. x=40
B. a, b,c三点由水电离出的c(H+)依次减小
C. b点时溶液的pOH>pH
D. a,b.d三点对应的NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:
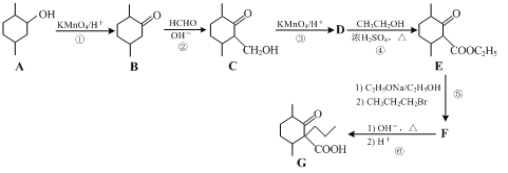
⑴下列说法正确的是______。
A.可以用NaHCO3溶液鉴别化合物A和G
B.有机物A分子中只含有2个手性碳原子
C.化合物B分子中所有碳原子可能位于同一平面
D.1 mol化合物E最多可与1 mol NaOH反应
⑵反应②的反应类型是______。
⑶化合物F的结构简式是______。
⑷写出一种满足下列条件的C的同分异构体的结构简式:______。
Ⅰ.含有六元环;Ⅱ.能发生银镜反应和水解反应;Ⅲ.分子含5种不同化学环境的氢。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com