
【题目】下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H=-57.4kJ/mol
D.己知C(s)+O2(g)═CO2(g)△H1,2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
【答案】C
【解析】
A. 燃烧热指的是在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,故241.8kJ/mol不是氢气的燃烧热,故A错误。
B. 由C(石墨,s)═C(金刚石,s)△H>0,可知反应吸热,即石墨的能量低于金刚石,而能量越低物质越稳定,故石墨比金刚石稳定,故B错误;
C. 在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热。20.0gNaOH的物质的量n= ![]() =
=![]() =0.5nol,与稀盐酸完全中和生成0.5mol水,此时放出热量28.7kJ,故当生成1mol水时放热57.4KJ,故该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol,故C正确;
=0.5nol,与稀盐酸完全中和生成0.5mol水,此时放出热量28.7kJ,故当生成1mol水时放热57.4KJ,故该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol,故C正确;
D. 反应 C(s)+O2(g)═CO2(g)△H1 ①和反应2C(s)+O2(g)=2CO(g)△H2 ②均为放热反应,△H均小于0,由于反应①是碳的完全燃烧,②是碳的不完全燃烧,故①放出的热量多于②,则△H1<△H2,故D错误;
答案选C。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】碱金属元素和卤族元素广泛存在,用化学用语回答下列问题。
(1)氢氟酸可以用来雕刻玻璃。用电子式表示氟化氢的形成过程__________。
(2)过氧化钠可以用于潜水艇中氧气的来源,其与二氧化碳反应的化学方程式是_____。
(3)次氯酸钠溶液(pH>7)和溴化钠溶液混合,可以作为角膜塑形镜的除蛋白液。二者混合后,溶液变成淡黄色,该反应的离子方程式是_____________________。
(4)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。组装该电池必须在无水条件下进行,原因是_____________(用化学方程式表示)。
(5)关于碱金属和卤族元素,下列说法一定正确的是____________。
A.从上到下,单质密度依次增大 B.从上到下,单质熔沸点依次升高
C.从上到下,原子半径依次增大 D.单质都可以与水反应
(6)常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
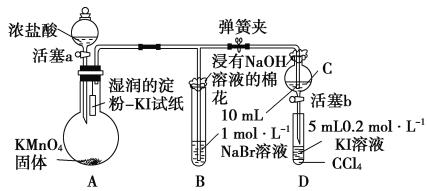
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
①验证氯气的氧化性强于碘的实验现象是____________________。
②B中溶液发生反应的离子方程式是__________________________。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是
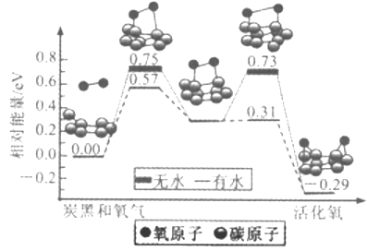
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A. x≤a,2I+Cl2=I2+2Cl
B. x=1.2a,10Fe2++14I+12Cl2=10Fe3++7I2+24Cl
C. x=1.4a,4Fe2++10I+7Cl2=4Fe3++5I2+14Cl
D. x≥1.5a,2Fe2++4I+3Cl2=2Fe3++2I2+6Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在生产生活中都具有重要的作用和意义:
(1)图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图:该电池的负极反应式为:_________,若串联该燃料电池来电解硫酸钠溶液,消耗4.6g二甲醚后总共可在电解池两极收集到13.44L(标况)气体,该套装置的能量利用率为___________.(保留三位有效数字)

(2)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_______。电解后,____室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。

(3)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:电解时发生反应的化学方程式为______。溶液X中大量存在的阴离子有___。

(4)测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL稀硫酸. 将一定量的混合气体通入混合溶液中充分吸收, 发生反应: 2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
Ⅱ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),以淀粉溶液为指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。
①滴定至终点的现象是______, 测得混合气中ClO2的质量为______ g。
②测定混合气中ClO2的含量的操作中可能使测定结果偏低的是____(填字母)。
A.滴定管未润洗就直接注入硫代硫酸钠标准液
B.锥形瓶用蒸馏水洗净后没有干燥
C.滴定管读取标准液体积时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图所示。下列分析正确的是

A. a点对应溶液的导电性比d点强
B. 氢硫酸的酸性比亚硫酸的酸性强
C. 向d点对应的溶液中加入Ba(NO3)2溶液,产生BaSO4白色沉淀
D. H2S饱和溶液的物质的量浓度为0.05 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 仅用水不能区分已烷、溴乙烷、乙醇三种液态有机物
B. 碳原子数小于或等于6的单烯烃,与HBr加成反应的产物只有1种结构,符合条件的单烯烃有3种
C. 苯、乙烷、乙烯、乙炔分子中碳碳键的键长分别为a、b、c、d,则![]() >d
>d
D. 等质量的烃完全燃烧,耗氧量最多的是甲烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com