
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:
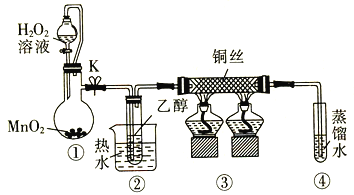
下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
科目:高中化学 来源: 题型:
【题目】下列实验操作和实验现象得出的结论中正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向5 mL0.1 mol/LKI溶液中加入0.1 mol/LFeCl3溶液10 mL,振荡,用苯萃取数次后取下层溶液,滴加5滴KSCN溶液 | 出现红色 | Fe3+与I-之间的反应是有一定限度的 |
B | 将己烯加入溴水中,振荡、静置,测溴水层溶液前后的pH | 溶液pH增大 | 说明己烯发生加成反应,不是取代反应 |
C | 用pH计分别测定饱和SO2溶液和饱和CO2溶液的pH | 饱和SO2溶液的pH小 | 酸性:H2SO3>H2CO3 |
D | 向酸性高锰酸钾溶液中滴加甲苯 | 溶液褪色 | 甲基对苯环产生影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将氨水滴入到FeCl3溶液中:Fe3++3OH-=Fe(OH)3↓
B.铜片跟氯化铁溶液反应: 2Fe3++3Cu=3Cu2++2Fe
C.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O
D.向FeCl3溶液中加入铁粉:Fe+2Fe3+=3Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月,科学家报道了利用磁性纳米Fe3O4颗粒除去水体草甘膦污染物的方法,其原理如图所示:(Fe3O4颗粒在水中表面会带—OH,在水体pH≈4时除污效果最好)。下列说法不正确的是( )
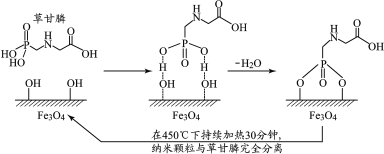
A.草甘膦既可以和盐酸反应,又可以和氢氧化钠溶液反应
B.Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂
C.Fe3O4纳米颗粒粒径越小、溶液中c(OH)越大除污效果越好
D.处理完成后,Fe3O4纳米颗粒可利用磁铁回收,经加热活化重复使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:
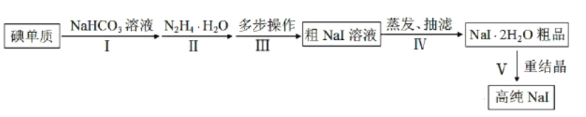
已知:
①I2(s)+I-(aq)![]() I
I![]() (aq)。
(aq)。
②水合肼(N2H4H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO![]() 离子。
离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为__。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是__。
(2)步骤Ⅱ,水合肼与IO-反应的离子方程式为__。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH值时依次加入的试剂为__。
A.NaOH B.HI C.NH3H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有__。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为__。
(5)将制备的NaI2H2O粗品以95%乙醇为溶剂进行重结晶。请给出合理的操作排序__。
加热95%乙醇→____→___→___→____→纯品(选填序号)。
①减压蒸发结晶 ②NaI2H2O粗品溶解 ③趁热过滤 ④真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学碘硫循环可用于大规模制氢气,SO2水溶液还原I2和HI分解均是其中的主要反应。回答下列问题:
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
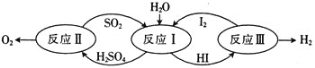
反应II包含两步反应:
①H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H2=+196kJ/mol
①写出反应①自发进行的条件是:________。
②写出反应Ⅱ的热化学方程式:________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
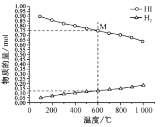
①该反应的△H ________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ___MPa,反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ____(用含k1、k-1、k2…的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为_____。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是_____(填元素符号)。
(3)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(4)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____ (“减弱”或“不变”)。铁晶体中粒子之间作用力类型是_____。
(5)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_____;
②CH4和HCHO比较,键角较大的是_____,主要原因是_____。
(6)钴晶胞和白铜(铜镍合金)晶胞分别如图1、2所示。
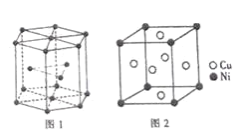
①钴晶胞堆积方式的名称为_____;
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____ pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.某无色澄清透明溶液中:K+ H+ Fe2+ Cl-
B.含0.1 mol·L-1OH-的溶液中:Na+ K+ ![]() ClO-
ClO-
C.含0.1 mol·L-1![]() 的溶液中:K+ Ca2+
的溶液中:K+ Ca2+ ![]()
![]()
D.含0.1 mol·L-1OH-的溶液中:Fe3+ ![]() Cu2+
Cu2+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A. x≤a,2I+Cl2=I2+2Cl
B. x=1.2a,10Fe2++14I+12Cl2=10Fe3++7I2+24Cl
C. x=1.4a,4Fe2++10I+7Cl2=4Fe3++5I2+14Cl
D. x≥1.5a,2Fe2++4I+3Cl2=2Fe3++2I2+6Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com