
【题目】热化学碘硫循环可用于大规模制氢气,SO2水溶液还原I2和HI分解均是其中的主要反应。回答下列问题:
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
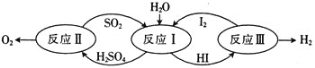
反应II包含两步反应:
①H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H2=+196kJ/mol
①写出反应①自发进行的条件是:________。
②写出反应Ⅱ的热化学方程式:________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
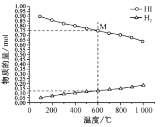
①该反应的△H ________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ___MPa,反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ____(用含k1、k-1、k2…的代数式表示)。
【答案】高温 2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol > 0.0125 ![]() (或0.167) 吸收
(或0.167) 吸收 ![]() c(H2)·c(I2)
c(H2)·c(I2)
【解析】
(1)由反应式①+②可得热化学方程式;
(2)①随着温度的不断升高,HI的物质的量不断减小,H2的物质的量不断增大,则平衡正向移动,所以正反应为吸热反应;
②从图中采集数据,600℃时,n(HI)=0.75mol,n(H2)=0.125mol,反应前后气体分子数不变,从而得出平衡分压![]() ,计算出各组分气体的分压,从而求得平衡常数;
,计算出各组分气体的分压,从而求得平衡常数;
(3)①第一步反应断裂共价键,吸收能量;
②反应速率由慢反应决定,即v=k3c(H2I)c(I),用第一步反应k1c(I2)=k-1c2(I),求出c(I)的表达式,用第二步的反应k2c(I)c(H2)=k-2c(H2I),求出c(H2I)的表达式,代入即可求得v。
(1)①反应①是气体物质的量增大的吸热反应,由![]() ,能自发进行的条件是高温,故答案为:高温;
,能自发进行的条件是高温,故答案为:高温;
②由反应式①+②可得出反应Ⅱ的热化学方程式:2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol;故答案为:2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol;
(2)①随着温度的不断升高,HI的物质的量不断减小,H2的物质的量不断增大,则平衡正向移动,所以正反应为吸热反应,该反应的△H>0,故答案为:>;
②从图中采集数据,600℃时,n(HI)=0.75mol,n(H2)=0.125mol,反应前后气体分子数不变,从而得出平衡分压![]() p,各气体的平衡分压:
p,各气体的平衡分压:![]() ,
,![]() ,反应HI(g)
,反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)的平衡常数
I2(g)的平衡常数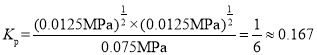 ,故答案为:0.0125;
,故答案为:0.0125;![]() (或0.167);
(或0.167);
(3)①第一步反应断裂共价键,吸收能量,故答案为:吸收;
②反应速率由慢反应决定,即v=k3c(H2I)c(I),
第一步是快速平衡,k1c(I2)=k-1c2(I),可得![]() ,第二步也是快速平衡,k2c(I)c(H2)=k-2c(H2I),可得
,第二步也是快速平衡,k2c(I)c(H2)=k-2c(H2I),可得![]() ,则速率方程为:
,则速率方程为:![]() ,故答案为:img src="http://thumb.zyjl.cn/questionBank/Upload/2020/07/22/00/8fe3223f/SYS202007220000202798657132_DA/SYS202007220000202798657132_DA.002.png" width="49" height="45" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />c(H2)·c(I2)。
,故答案为:img src="http://thumb.zyjl.cn/questionBank/Upload/2020/07/22/00/8fe3223f/SYS202007220000202798657132_DA/SYS202007220000202798657132_DA.002.png" width="49" height="45" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />c(H2)·c(I2)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
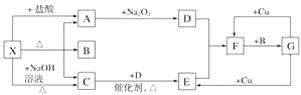
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成某药物的中间体,一种合成H的路线如下(部分条件和产物省略):
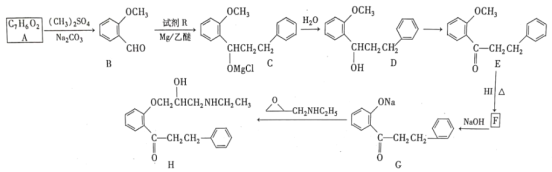
已知:①RCHO![]()
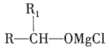
②A能发生银镜反应,遇FeCl3溶液发生显色反应。
请回答下列问题:
(1)A所含官能团的名称是___________。1个H分子含___________个手性碳原子。
(2)D→E的反应条件和试剂为___________。G→H的反应类型是___________。
(3)设计A→B、E→F步骤的目的是__________。
(4)写出B→C的化学方程式:______。
(5)在B的同分异构体中,能发生水解反应的结构有___________种(不考虑立体异构)。其中,在核磁共振氢谱上有4组峰且峰的面积比为1:2:2:3的结构简式可能为____________。
(6)参照上述流程,以乙醇为有机物原料合成2-丁醇(其他试剂自选),设计合成路线:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016 年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB 族元素对应离子的萃取,如La3+、Sc2+。写出基态二价 钪离子(Sc2+)的核外电子排布式:____,其中电子占据的轨道数为_____个。
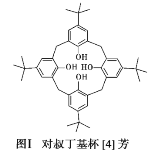
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为_____,羟基间的相互作用力为_____。
(3)不同大小苯芳烃能识别某些离子,如:N3-、SCN等。一定条件下,SCN与 MnO2反应可得到(SCN)2,试写出(SCN)2的结构式_______。
(4)NH3分子在独立存在时 H-N-H 键角为 106.7°。 [Zn(NH3)6]2+离子中 H-N-H 键角变为 109.5°,其原因是:_________________________。
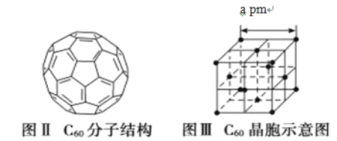
(5)已知 C60 分子结构和 C60 晶胞示意图(如图Ⅱ、图Ⅲ所示):则一个 C60 分子中含有σ键的个数为______,C60 晶体密度的计算式为____gcm3。(NA 为阿伏伽德罗常数 的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:
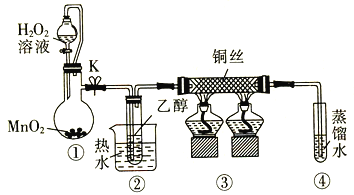
下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G是4-羟基香豆素,是重要的医药中间体,可用来制备抗凝血药,可通过下列路线合成。
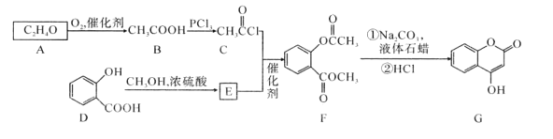
请回答:
(1)D→E的反应类型是___。
(2)G中含有的官能团名称为____。
(3)写出G和过量NaOH溶液共热时反应的化学方程式___。
(4)化合物E的同分异构体很多,符合下列条件的结构共___种。
①能与氯化铁溶液发生显色反应;②能发生银镜反应;③能发生水解反应
其中,核磁共振氢谱为5组峰,且峰面积比为2:2:2:1:1的结构简式为____。
(5)E的同分异构体很多,所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是___(填标号)。
a.质谱仪 b.元素分析仪 c.红外光谱仪 d.核磁共振仪
(6)已知酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选):___。
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选):___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用下列装置完成了探究浓硫酸和 SO2性质的实验(部分夹持装置已省略),下列“ 现象预测” 与“ 解释或结论” 均正确的是
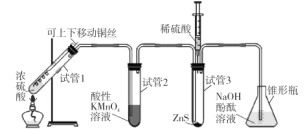
选项 | 仪器 | 现象预测 | 解释或结论 |
A | 试管1 | 有气泡、酸雾,溶液中有白色固体出现 | 酸雾是SO2所形成,白色固体是硫酸铜晶体 |
B | 试管2 | 紫红色溶液由深变浅,直至褪色 | SO2具有还原性 |
C | 试管3 | 注入稀硫酸后,没有现象 | 由于Ksp(ZnS)太小,SO2与ZnS在注入稀硫酸后仍不反应 |
D | 锥形瓶 | 溶液红色变浅 | NaOH溶液完全转化为NaHSO3溶液,NaHSO3溶液碱性小于NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=![]() lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
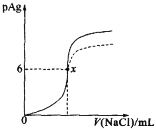
A.原AgNO3溶液的物质的量浓度为1mol·L-1
B.图中x点的坐标为(100,6)
C.图中x点可认为溶液中Ag+被沉淀完全
D.把0.1mol·L-1的NaCl换成0.1mol·L-1NaI,则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型实验具有装置小巧、节约药品、操作简便、现象明显、安全可靠、减少污染等优点,下图是某同学设计的实验室制取Cl2并探究其化学性质的微型装置(图中夹持装置均略去)。
查阅资料:氯气的氧化性大于HIO3。
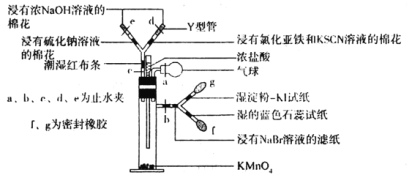
回答下列问题:
(1)实验室中可代替图中添加浓盐酸的仪器名称是___________。
(2)加入浓盐酸后试管内发生反应的化学方程式是__________________________________。
(3)探究氯气的化学性质,将实验现象填写在下表对应的空格里:___________
操作步骤 | 实验现象 |
缓慢加入浓盐酸,打开c、d、e,使产生的氯气缓慢充入Y试管 | |
关闭c打开b,使氯气缓慢进入Y管中 |
(4)实验中发现若氯气的通入量过多,淀粉碘化钾试纸会逐渐变为无色,可能的原因是__________________________________________________。
(5)此装置___________(填“能”或“不能”)证明氧化性顺序Cl2>Br2>I2,原因是___________,实验完毕后,关闭止水夹b,打开a、c,挤压气球,目的是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com