
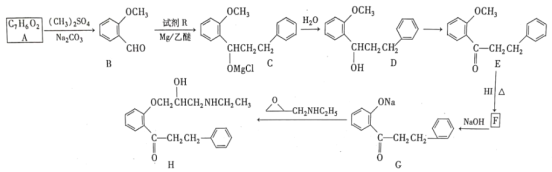
【题目】H是合成某药物的中间体,一种合成H的路线如下(部分条件和产物省略):
已知:①RCHO![]()
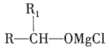
②A能发生银镜反应,遇FeCl3溶液发生显色反应。
请回答下列问题:
(1)A所含官能团的名称是___________。1个H分子含___________个手性碳原子。
(2)D→E的反应条件和试剂为___________。G→H的反应类型是___________。
(3)设计A→B、E→F步骤的目的是__________。
(4)写出B→C的化学方程式:______。
(5)在B的同分异构体中,能发生水解反应的结构有___________种(不考虑立体异构)。其中,在核磁共振氢谱上有4组峰且峰的面积比为1:2:2:3的结构简式可能为____________。
(6)参照上述流程,以乙醇为有机物原料合成2-丁醇(其他试剂自选),设计合成路线:________。
【答案】羟基、醛基 1 O2/Cu 加热 加成反应 保护酚羟基 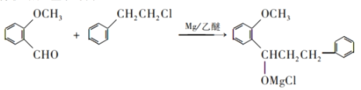 6
6 ![]() (写出任意一种即可)
(写出任意一种即可) 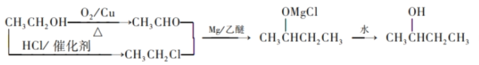
【解析】
根据A的特征实验现象,A含醛基、酚羟基,故A为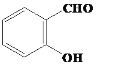 ,E与HI反应生成F,F能与碱反应,说明F有活泼氢,F为
,E与HI反应生成F,F能与碱反应,说明F有活泼氢,F为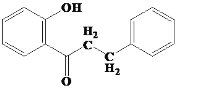 ,据此解答。
,据此解答。
(1)有机物A中含有羟基、醛基;1个H含有1个手性碳原子,用星号标出,如图所示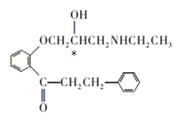 ;
;
(2) D中醇羟基催化氧化生成E,条件和试剂是氧气在铜催化下并加热;G转化成H,断裂三元环,形成2个单键,类似断裂双键形成单键,增大饱和度,属于加成反应;
(3) A中酚羟基能与镁、氧化剂等反应,故先保护羟基;
(4)参照C的结构简式和已知信息,RCl为 ,故B→C的化学方程式为
,故B→C的化学方程式为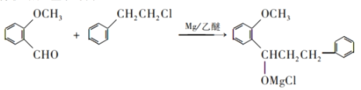 ;
;
(5)B的同分异构体中可以发生水解,说明含有酯基,含有酯基的同分异构体有6种,分别为 、
、 (邻、间、对三种);其中核磁共振氢谱的结构有4组峰且峰的面积比为1:2:2:3的有3种,分别为
(邻、间、对三种);其中核磁共振氢谱的结构有4组峰且峰的面积比为1:2:2:3的有3种,分别为![]() ;
;
(6)以乙醇为合成路线制备2-丁醇,首先将乙醇氧化为乙醛,再将乙醇与HCl反应生成CH3CH2Cl,乙醛和CH3CH2Cl在Mg/乙醚的条件下发生已知条件的反应,后经过水解生成目标产物,具体的路线为 。
。


科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是
A.该原电池的正极反应是Cu2++2e-=Cu
B.甲烧杯中溶液的血红色逐渐变浅
C.盐桥中的SO42-流向甲烧杯
D.Cu电极质量减少,Pt电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“翠矾”(NiSO4·7H2O)在印染工业作媒染剂,生产酞菁艳蓝络合剂;氟镍化钾(K2NiF4)是结构化学研究的热点物质。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料合成“翠矾”和氟镍化钾的流程如下:
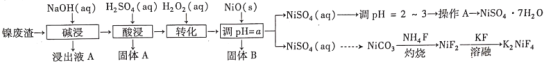
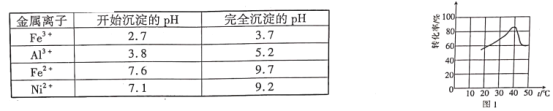
几种金属离子的氢氧化物沉淀pH如下:
请回答下列问题:
(1)翠矾、绿矾、明矾、蓝矾等“矾类”都含有______元素(填元素符号)。pH=a的范围为___________。
(2)“转化”过程中一定体积和浓度的双氧水,“转化率”与温度关系如图1所示。温度高于40℃,转化率急速降低的原因可能是______。空气可以替代双氧水,空气的作用是______(用离子方程式表示)。
(3)NiSO4和NH4HCO3溶液生成NiCO3,其离子方程式为___________。
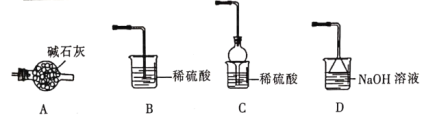
(4)灼烧NiCO3和NH4F以物质的量之比为1:1组成的混合物时,为避免污染环境,选择下列装置吸收尾气,最宜选择___________。(填选项)
(5)已知常温下,Ksp(NiCO3)=1.42×10-7。分离NiCO3时滤液中c(Ni2+)≤1.0×10-5 mol·L-1时,c(CO![]() )≥___________mol·L-1。
)≥___________mol·L-1。
(6)准确称取ω g翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250 mL溶液,取20.00 mL所配溶液于锥形瓶,用c mol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02 mL、19.98 mL、19.50 mL,则翠矾的纯度为___________%(只列计算式,不考虑杂质反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )

A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性
C.氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化
D.形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将氨水滴入到FeCl3溶液中:Fe3++3OH-=Fe(OH)3↓
B.铜片跟氯化铁溶液反应: 2Fe3++3Cu=3Cu2++2Fe
C.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O
D.向FeCl3溶液中加入铁粉:Fe+2Fe3+=3Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。如图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
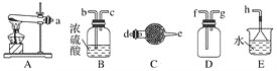
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接__、___接__,__接h;实验室用A装置制取NH3的化学方程式为___。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是___,试写出制纳米级碳酸钙的化学方程式:___。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月,科学家报道了利用磁性纳米Fe3O4颗粒除去水体草甘膦污染物的方法,其原理如图所示:(Fe3O4颗粒在水中表面会带—OH,在水体pH≈4时除污效果最好)。下列说法不正确的是( )
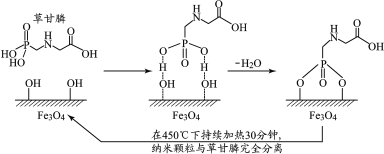
A.草甘膦既可以和盐酸反应,又可以和氢氧化钠溶液反应
B.Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂
C.Fe3O4纳米颗粒粒径越小、溶液中c(OH)越大除污效果越好
D.处理完成后,Fe3O4纳米颗粒可利用磁铁回收,经加热活化重复使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学碘硫循环可用于大规模制氢气,SO2水溶液还原I2和HI分解均是其中的主要反应。回答下列问题:
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
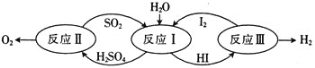
反应II包含两步反应:
①H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H2=+196kJ/mol
①写出反应①自发进行的条件是:________。
②写出反应Ⅱ的热化学方程式:________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
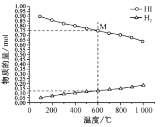
①该反应的△H ________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ___MPa,反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ____(用含k1、k-1、k2…的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的数值,下列说法不正确的是
A.500mL 0.1mol/L的Na2SO4溶液中含Na+数目为0.1NA
B.标准状况下,11.2L H2O含有氧原子大于0.5NA
C.常温常压下,32 g氧气(O2)和臭氧(O3)的混合气体中含有的氧原子数为2NA
D.标准状况下,2.24 L N2和O2的混合气体中原子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com