
【题目】某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是
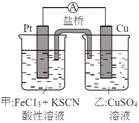
A.该原电池的正极反应是Cu2++2e-=Cu
B.甲烧杯中溶液的血红色逐渐变浅
C.盐桥中的SO42-流向甲烧杯
D.Cu电极质量减少,Pt电极质量增加
【答案】B
【解析】
在乙图装置中,Cu易失电子作负极、Cu作负极,当电流计中指针发生偏转时,盐桥中钾离子向正极移动,所以盐桥中的SO42-流向乙烧杯移动,Cu作负极,负极上Cu失电子发生氧化反应,电极反应式为Cu-2e-= Cu2+,Pt为正极,正极上铁离子得电子发生还原反应,电极反应为Fe3++e-=Fe2+,甲烧杯中溶液的血红色逐渐变浅。
A.由分析可知,Cu失去电子作负极,Fe3+得到电子做正极,故正极的电极反应式为Fe3++e-=Fe2+,A错误;
B.甲烧杯中随着电池反应的不断进行,甲烧杯中的Fe3+浓度不断减小,溶液颜色逐渐变浅,B正确;
C.由于乙烧杯中Cu失去电子变成Cu2+,故盐桥中的SO42-向乙烧杯移动,C错误;
D.根据电极反应,Cu电极消耗Cu,质量变小,Pt电极消耗Fe3+变成Fe2+,电极质量不变,D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂的流程如图:
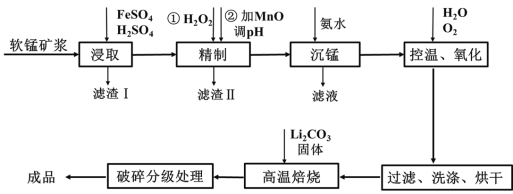
已知: lg2=0.3,![]() =8,25℃有关物质的溶度积常数:
=8,25℃有关物质的溶度积常数:
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 5.12×10-33 | 4.0×l0-14 |
(1)已知锂电池放电时正极的电极反应式为:LiMn2O4+e-+Li+ ===Li2Mn2O4,则锰酸锂中锰元素的化合价为____。
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_____,检验还含有Fe2+的方法是______。
(3)“精制”中加入H2O2的量比理论值大的多,其主要原因是______,若所得溶液中锰离子的浓度为1 mol·L-1,则加入氧化锰调节pH的范围为____(当溶液中离子浓度小于10-5 mol·L-1时可以认为沉淀完全)。
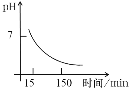
(4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为Mn3O4,若控温氧化时溶液的pH随时间的变化如下图,则15~150 min内滤饼中一定参加反应的成分是______;判断的理由是____(用化学方程式表示)。
(5)写出高温煅烧生成锰酸锂的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁是人体必需的微量元素,目前市售补铁营养品较多,某研究性学习小组对补铁剂中铁的含量进行了测定。提供药品:FeCl2溶液(浅绿色)、FeCl3溶液(黄色)、铁粉、铜粉、KSCN溶液、氯水;仪器自选。
①将补铁剂中的Fe2+转化成Fe3+,结合你所选的试剂写出相关的离子方程式:______。
②若将Fe3+转化成Fe2+,结合你所选的试剂写出相关的离子方程式:__________。
(2)“服用维生素C,可使食物中的三价铁离子还原成二价铁离子”这句话指出维生素C在这一反应中做____剂,具有____性。
(3)某同学根据铁元素价态特点,提出这样一个观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉足量时产物是FeCl2,为验证该观点是否正确,该同学将一定质量铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
①提出假设:
假设1:该固体物质是FeCl2。
假设2:该固体物质是_______。
②设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
实验方法 | 实验现象 | 结论 |
在A溶液中加KSCN溶液 | _______ | 固体物质中有FeCl3 |
在酸性高锰酸钾溶液中加少量A溶液 | 酸性高锰酸钾溶液颜色无明显变化 | _______ |
③根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究合成氨方法的历史上,不同的研究者曾3次获诺贝尔化学奖。合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药等的原料。下列说法中正确的是
A. N2和H2在点燃或光照条件下可合成NH3
B. NH3和HNO3溶于水后都能导电,故二者都是电解质
C. NH3遇到浓硝酸会发生反应产生大量白烟
D. 由NH3制HNO3的过程中,氮元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
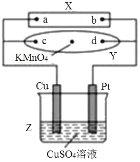
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构∧,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
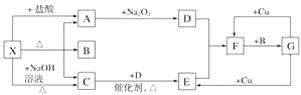
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成某药物的中间体,一种合成H的路线如下(部分条件和产物省略):
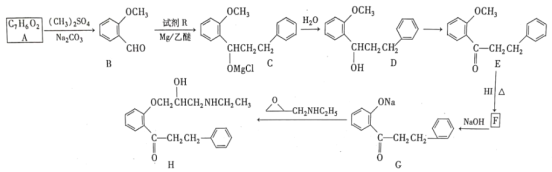
已知:①RCHO![]()
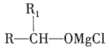
②A能发生银镜反应,遇FeCl3溶液发生显色反应。
请回答下列问题:
(1)A所含官能团的名称是___________。1个H分子含___________个手性碳原子。
(2)D→E的反应条件和试剂为___________。G→H的反应类型是___________。
(3)设计A→B、E→F步骤的目的是__________。
(4)写出B→C的化学方程式:______。
(5)在B的同分异构体中,能发生水解反应的结构有___________种(不考虑立体异构)。其中,在核磁共振氢谱上有4组峰且峰的面积比为1:2:2:3的结构简式可能为____________。
(6)参照上述流程,以乙醇为有机物原料合成2-丁醇(其他试剂自选),设计合成路线:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com