
【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂的流程如图:
已知: lg2=0.3,![]() =8,25℃有关物质的溶度积常数:
=8,25℃有关物质的溶度积常数:
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 5.12×10-33 | 4.0×l0-14 |
(1)已知锂电池放电时正极的电极反应式为:LiMn2O4+e-+Li+ ===Li2Mn2O4,则锰酸锂中锰元素的化合价为____。
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_____,检验还含有Fe2+的方法是______。
(3)“精制”中加入H2O2的量比理论值大的多,其主要原因是______,若所得溶液中锰离子的浓度为1 mol·L-1,则加入氧化锰调节pH的范围为____(当溶液中离子浓度小于10-5 mol·L-1时可以认为沉淀完全)。
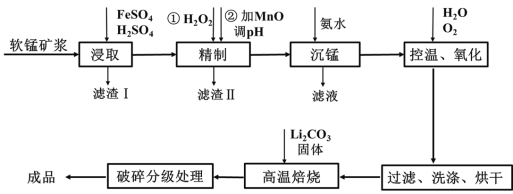
(4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为Mn3O4,若控温氧化时溶液的pH随时间的变化如下图,则15~150 min内滤饼中一定参加反应的成分是______;判断的理由是____(用化学方程式表示)。
(5)写出高温煅烧生成锰酸锂的化学方程式_______。
【答案】+3、+4 MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O 取浸取液少许,加入几滴K3[Fe(CN)6]溶液(或酸性KMnO4溶液),若有蓝色沉淀生成(或紫红色褪去),则有Fe2+ 溶液中的铁离子催化过氧化氢分解 4.9-7.3 Mn2(OH)2SO4 3 Mn2(OH)2SO4+O2===2Mn3O4+3H2SO4 8Mn3O4 +6Li2CO3 +5O2![]() 6CO2 + 12LiMn2O4
6CO2 + 12LiMn2O4
【解析】
(2)用K3[Fe(CN)6] 溶液来检验Fe2+:
(3)“浸取”过程还剩余Fe3+,溶液中的铁离子催化过氧化氢分解;氢氧化铝完全沉淀时,铝离子浓度为10-5 mol·L-1,用Al(OH)3的Ksp计算氢氧根浓度,从而得到氢离子浓度,算得调节溶液最小的pH,锰离子的浓度为1 mol·L-1,用Mn(OH)2的Ksp计算氢氧根浓度,从而得到氢离子浓度,算得调节溶液最大的pH;
(4)将MnSO4溶液于氨水混合得到含有Mn(OH)2、Mn2(OH)2SO4的滤饼,将滤饼洗涤后加入蒸馏水并通入氧气,可能发生反应6Mn(OH)2+O2=2Mn3O4+6H2O、3Mn2(OH)2SO4+O2=2Mn3O4+3H2SO4;
(1) Li2Mn2O4中锰元素+3价,则LiMn2O4中锰元素有+4价,但只有一个锰原子得电子,另一个锰原子未得电子变价,也为+4价,则锂电池正极材料锰酸锂中,锰元素的化合价为+3、+4;故答案为:+3、+4;
(2) “浸取”过程MnO2转化为Mn2+,Mn元素从+4价降至+2价,离子方程式为:MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O;可用K3[Fe(CN)6] 溶液来检验Fe2+:取浸取液少许,加入几滴K3[Fe(CN)6]溶液(或酸性KMnO4溶液),若有蓝色沉淀生成(或紫红色褪去),则有Fe2+;
(3) “浸取”过程还剩余Fe3+,“精制”中加入H2O2消耗一部分,故过氧化氢的量比理论值大的多,故答案为:溶液中的铁离子催化过氧化氢分解;除去Fe3+、Al3+,氢氧化铝完全沉淀时,![]() ,解得
,解得![]() ,
,![]() ,pH=4.9,锰离子的浓度为1 mol·L-1时,
,pH=4.9,锰离子的浓度为1 mol·L-1时,![]() ,
,![]() ,
,![]() ,pH=7.3,调节pH的范围为4.9-7.3;
,pH=7.3,调节pH的范围为4.9-7.3;
(4) 根据分析,滤饼含有Mn(OH)2、Mn2(OH)2SO4,与氧气可能的反应分别为6Mn(OH)2+O2=2Mn3O4+6H2O、3Mn2(OH)2SO4+O2=2Mn3O4+3H2SO4,则Mn2(OH)2SO4被O2氧化产生H+,而Mn(OH)2被O2氧化不产生H+,根据图象通入O2时15~150分钟pH越来越小,酸性增强,则15~150分钟滤饼中一定参与反应的成分是Mn2(OH)2SO4;故答案为:Mn2(OH)2SO4;3 Mn2(OH)2SO4+O2===2Mn3O4+3H2SO4;
(5)高温煅烧生成锰酸锂的化学方程式:8Mn3O4 +6Li2CO3 +5O2![]() 6CO2 + 12LiMn2O4。
6CO2 + 12LiMn2O4。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2g碳与水蒸气完全反应生成水煤气时,吸收了13.16kJ热量。该反应的热化学方程式为___;该反应在条件下能自发进行___(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。

①T1___T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1___(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是___(填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
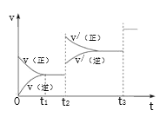
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___;t3时采取的措施可能是___。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=___(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。
(1)Fe基态核外电子排布式为___________;![]() 中与Fe2+配位的原子是________(填元素符号)。
中与Fe2+配位的原子是________(填元素符号)。
(2)NH3分子中氮原子的轨道杂化类型是____________;C、N、O元素的第一电离能由大到小的顺序为_______________。
(3)与NH![]() 互为等电子体的一种分子为_______________(填化学式)。
互为等电子体的一种分子为_______________(填化学式)。
(4)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_________mol。
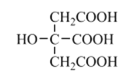
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料α-Fe2O3。
其主要实验流程如下:
![]()
(1)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有___________(填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成___________(填化学式);检验Fe3+是否还原完全的实验操作是______________。
(3)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是___________[![]() ,
,![]() ]。
]。
(4)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为____________。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:__。
(FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有 Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是

A. 若原溶液中不存在 Na+,则 c(Cl-)<0.1molL﹣1
B. 原溶液可能存在 Cl- 和 Na+
C. 原溶液中 c(CO32-)是 0.01molL﹣1
D. 原溶液一定存在 CO32-和SO42-,一定不存在 Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是( )
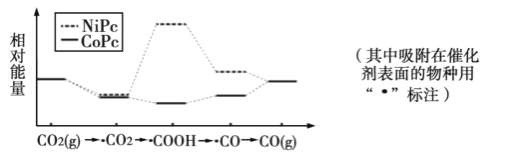
A.CO2经还原反应得到COOH
B.该研究成果将有利于缓解温室效应,并解决能源转化问题
C.相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同
D.催化剂可以改变CO2转化为CO反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是
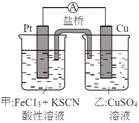
A.该原电池的正极反应是Cu2++2e-=Cu
B.甲烧杯中溶液的血红色逐渐变浅
C.盐桥中的SO42-流向甲烧杯
D.Cu电极质量减少,Pt电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“翠矾”(NiSO4·7H2O)在印染工业作媒染剂,生产酞菁艳蓝络合剂;氟镍化钾(K2NiF4)是结构化学研究的热点物质。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料合成“翠矾”和氟镍化钾的流程如下:
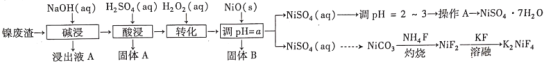
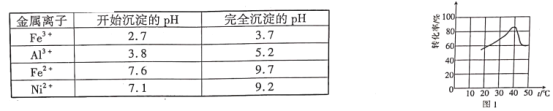
几种金属离子的氢氧化物沉淀pH如下:
请回答下列问题:
(1)翠矾、绿矾、明矾、蓝矾等“矾类”都含有______元素(填元素符号)。pH=a的范围为___________。
(2)“转化”过程中一定体积和浓度的双氧水,“转化率”与温度关系如图1所示。温度高于40℃,转化率急速降低的原因可能是______。空气可以替代双氧水,空气的作用是______(用离子方程式表示)。
(3)NiSO4和NH4HCO3溶液生成NiCO3,其离子方程式为___________。
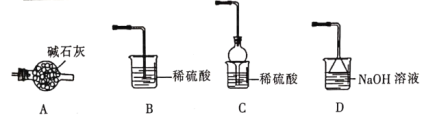
(4)灼烧NiCO3和NH4F以物质的量之比为1:1组成的混合物时,为避免污染环境,选择下列装置吸收尾气,最宜选择___________。(填选项)
(5)已知常温下,Ksp(NiCO3)=1.42×10-7。分离NiCO3时滤液中c(Ni2+)≤1.0×10-5 mol·L-1时,c(CO![]() )≥___________mol·L-1。
)≥___________mol·L-1。
(6)准确称取ω g翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250 mL溶液,取20.00 mL所配溶液于锥形瓶,用c mol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02 mL、19.98 mL、19.50 mL,则翠矾的纯度为___________%(只列计算式,不考虑杂质反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com