
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2g碳与水蒸气完全反应生成水煤气时,吸收了13.16kJ热量。该反应的热化学方程式为___;该反应在条件下能自发进行___(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。

①T1___T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1___(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是___(填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
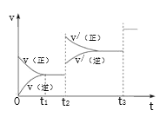
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___;t3时采取的措施可能是___。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=___(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ·mol-1 高温 < > cd 加压 加入催化剂 66.7
【解析】
(1) 1.2g碳的物质的量为0.1mol,与水蒸气完全反应生成CO、H2,吸收13.16kJ热量,则1molC与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,据此书写热化学方程式;依据△G=△H-T△S<0分析判断;
(2)①由达到平衡所需要的时间长短知温度的大小关系,根据温度对平衡移动的影响来回答判断;②根据影响化学平衡的因素分析判断;③由图可知,t2时正逆反应速率均增大,且正反应速率大于逆反应速率,平衡正向移动;t3时正、逆反应速率均增大,正反应速率=逆反应速率,平衡不移动,结合化学平衡的因素分析判断;④同温同体积条件下,气体的物质的量之比=压强之比,结合三段式计算。
(1)1.2g碳的物质的量为0.1mol,与水蒸气完全反应生成CO、H2,吸收13.16kJ热量,则1molC与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJmol-1;
C(s)+H2O(g)=CO(g)+H2(g),该反应是气体体积变大的反应,体系混乱度变大,则△S>0;△G=△H-T△S<0,反应能自发进行,而△H>0,△S>0,说明在高温条件下△G才为负值;
(2)①由达到平衡所需要的时间长短知T1<T2,当温度由T2→T1,即降温时,CO的转化率增大,说明降低温度时平衡向右移动,故正反应是放热反应;放热反应,温度越低,平衡常数越大,则K1>K2;
②A.降低温度,平衡正向移动,CO转化率增大,故错误;
B.将CH3OH(g)从体系中分离,平衡正向移动,CO转化率增大,故错误;
C.使用合适的催化剂,平衡不移动,CO转化率不变,故正确;
D.充入He,使体系总压强增大,各组分的浓度不变,平衡不移动,CO转化率不变,故正确;
答案为:cd;
③由图可知,t2时正、逆反应速率均增大,且正反应速率大于逆反应速率,因反应为气体体积减小的放热反应,可知t2时采取的措施可能是增大压强。t3时正、逆反应速率均增大,正反应速率=逆反应速率,平衡不移动,可知t3时采取的措施可能是加入催化剂;
④同温同体积条件下,气体的物质的量之比等于压强之比,设CO和H2的物质的量为1mol,转化的CO为xmol,则
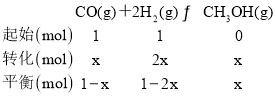
则![]() =
=![]() ,解得:x=0.4,则CO、H2、CH3OH的平衡分压分别为
,解得:x=0.4,则CO、H2、CH3OH的平衡分压分别为![]() ×0.6MPa=0.3MPa、
×0.6MPa=0.3MPa、![]() ×0.6MPa=0.1 MPa、
×0.6MPa=0.1 MPa、![]() ×0.6MPa=0.2 MPa,则KP=
×0.6MPa=0.2 MPa,则KP=![]() =66.7(MPa)-2。
=66.7(MPa)-2。


科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用海带为原料制取少量碘。其实验操作可分解为如下几步
A.将海带灼烧成灰
B.______________
C.使用新制氯水置换出碘单质,反应方程式:Cl2+2KI=2KCl+I2
D. 萃取
E.得到固体碘
回答下列问题
(1)写出步骤A中需要的仪器_______。
(2)步骤B的实验操作名称_________。
(3)步骤D中向分液漏斗中加入苯作萃取剂后,如何操作可使两种溶液充分接触,_______;碘进入______层液体,颜色为________。
(4)步骤E中得到固体碘,还需要的仪器为______。
A. B.
B.![]() C.
C. D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.c点对应的Ksp等于a点对应的Ksp
B.加入AgNO3,可以使溶液由c点变到d点
C.d点没有AgCl沉淀生成
D.加入少量水,平衡右移,Cl-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以旋转,结构简式为 ![]() 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中最多有6个碳原子处于同一直线上
B. 该烃苯环上的一氯代物有3种
C. 分子中至少有12个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2 。碳原子连有4个不同的原子或基团时,该碳称为手性碳,下列分析不正确的是
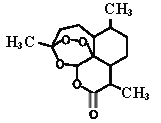
A. 推测青蒿素在乙醚中的溶解度大于在水中的溶解度
B. 青蒿素可以与NaOH、Na2CO3 、NaHCO3反应
C. 青蒿素分子中含有手性碳
D. 青蒿素中对热不稳定且具有氧化性的基团是“-O-O-”
查看答案和解析>>
科目:高中化学 来源: 题型:
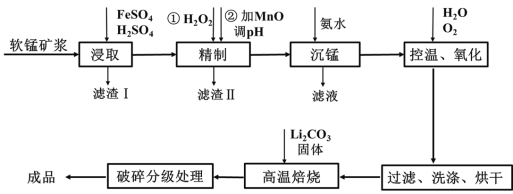
【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂的流程如图:
已知: lg2=0.3,![]() =8,25℃有关物质的溶度积常数:
=8,25℃有关物质的溶度积常数:
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 5.12×10-33 | 4.0×l0-14 |
(1)已知锂电池放电时正极的电极反应式为:LiMn2O4+e-+Li+ ===Li2Mn2O4,则锰酸锂中锰元素的化合价为____。
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_____,检验还含有Fe2+的方法是______。
(3)“精制”中加入H2O2的量比理论值大的多,其主要原因是______,若所得溶液中锰离子的浓度为1 mol·L-1,则加入氧化锰调节pH的范围为____(当溶液中离子浓度小于10-5 mol·L-1时可以认为沉淀完全)。
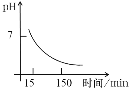
(4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为Mn3O4,若控温氧化时溶液的pH随时间的变化如下图,则15~150 min内滤饼中一定参加反应的成分是______;判断的理由是____(用化学方程式表示)。
(5)写出高温煅烧生成锰酸锂的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构∧,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com