
【题目】某化学课外小组用海带为原料制取少量碘。其实验操作可分解为如下几步
A.将海带灼烧成灰
B.______________
C.使用新制氯水置换出碘单质,反应方程式:Cl2+2KI=2KCl+I2
D. 萃取
E.得到固体碘
回答下列问题
(1)写出步骤A中需要的仪器_______。
(2)步骤B的实验操作名称_________。
(3)步骤D中向分液漏斗中加入苯作萃取剂后,如何操作可使两种溶液充分接触,_______;碘进入______层液体,颜色为________。
(4)步骤E中得到固体碘,还需要的仪器为______。
A.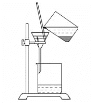 B.
B.![]() C.
C.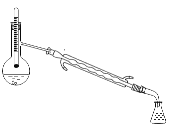 D.
D. 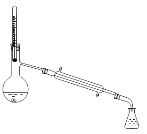
【答案】坩埚、坩埚钳、三角架(或带铁圈的铁架台)、泥三角、酒精灯 溶解、过滤 盖好玻璃塞,倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正,静置、分层 上 紫红 D
【解析】
灼烧海带时用坩埚盛放海带,用三角架和泥三角上放置坩埚,用酒精灯进行加热,海带灼烧→海带灰→加水溶解、过滤→滤液中通入氯气→液体装入到分液漏斗中,并加入苯→盖上玻璃塞,振荡、静置、分层→分液→蒸馏得到碘固体。据此解答。
(1)灼烧海带时用坩埚盛放海带,用三角架和泥三角上放置坩埚,用酒精灯进行加热,故将海带灼烧成灰需要用到的仪器有:坩埚、坩埚钳、三角架(或带铁圈的铁架台)、泥三角、酒精灯;
(2)将海带灰加水溶解得到海带灰的悬浊液,然后过滤;
(3)步骤D中向分液漏斗中加入苯作萃取剂后,盖好玻璃塞,倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正,静置、分层;苯的密度比水的密度小,并且碘在苯中的溶解度大于苯在水中的溶解度,因此碘进入上层苯液中,上层液体呈紫红色;
(4)因为碘单质与苯互溶,且苯与碘的沸点不同,所以采用蒸馏的方式得当碘,蒸馏操作时,温度计放在蒸馏烧瓶支管口处。A是过滤操作,用于分离固体与液体互不相溶的物质,此操作不能从碘的苯溶液中得到碘固体,A错误;B是分离两种互不相溶的液体,此操作不能从碘的苯溶液中得到碘固体,B错误;C是蒸馏操作中用直形冷凝管,不能用球形冷凝管,并且温度计放在蒸馏烧瓶支管口处,C错误;D装置可以从碘的苯溶液中得到碘固体,D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化)。下列说法中不正确的是( )
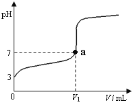
A. 上述 CH3COOH溶液中:c(H+)=1×10-3 mol·L-1
B. 图中V1 <20 mL
C. a点对应的溶液中:c (CH3COO-)=c (Na+)
D. 当加入NaOH溶液的体积为20 mL时,溶液中:c (CH3COOH) + c (H+)>c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的检验说法不正确的是( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸沉淀不消失,一定含有![]()
B.观察钾元素焰色反应的操作是:将铂丝用稀盐酸洗涤后灼烧至火焰为无色,然后再用铂丝蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有![]()
D.待检液加入氯化钡溶液有白色沉淀生成,再加入足量盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为第三金属,广泛用于航空航天领域。硼化钒(VB2)—空气电池的放电反应为4VB2+11O2=4B2O3+2V2O5,以该电池为电源制备钛的装置如图所示,下列说法正确的是( )
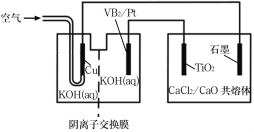
A.电解过程中,OH-由阴离子交换膜右侧向左侧迁移
B.Pt极反应式为2VB2+22OH--22e-=V2O5+2B2O3+11H2O
C.电解过程中,铜极附近电解质溶液的pH增大
D.若石墨电极上只收集到4.48L气体,则理论上制备4.8gTi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图(见下页):
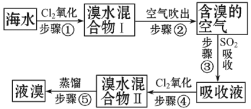
(1)步骤①反应的离子方程式是___。
(2)步骤③反应的化学方程式是___,从理论上考虑,下列也能吸收Br2的是___。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80℃~90℃。温度过高或过低都不利于生产,请解释原因:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以CaCO3为原料,制备CO2并获得CaCl2﹒6H2O晶体。下列图示装置和原理不能达到实验目的的是
A.制备CO2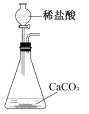
B.收集CO2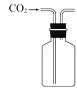
C.滤去CaCO3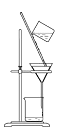
D.制得CaCl2﹒6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2g碳与水蒸气完全反应生成水煤气时,吸收了13.16kJ热量。该反应的热化学方程式为___;该反应在条件下能自发进行___(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。

①T1___T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1___(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是___(填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___;t3时采取的措施可能是___。
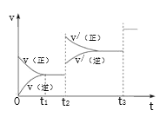
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=___(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是( )
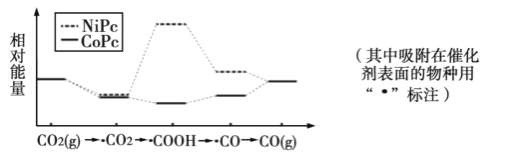
A.CO2经还原反应得到COOH
B.该研究成果将有利于缓解温室效应,并解决能源转化问题
C.相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同
D.催化剂可以改变CO2转化为CO反应的焓变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com