
����Ŀ�������£���20 mL x mol��L��1 CH3COOH��Һ����μ�������ʵ���Ũ�ȵ�NaOH��Һ�����Һ��pH��NaOH��Һ�������V���ı仯��ϵ��ͼ��ʾ�������¶ȱ仯��������˵���в���ȷ���ǣ� ��
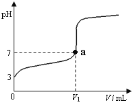
A. ���� CH3COOH��Һ�У�c(H+)��1��10��3 mol��L��1
B. ͼ��V1 <20 mL
C. a���Ӧ����Һ�У�c (CH3COO��)��c (Na+��
D. ������NaOH��Һ�����Ϊ20 mLʱ����Һ�У�c (CH3COOH) + c (H+)��c (OH����
���𰸡�D
��������
A����ͼ���֪������NaOH��Һ֮ǰ��������Һ��pH=3��˵����Һ��c(H+)=1��10-3molL-1����A��ȷ��
B�������ʵ���Ũ�ȶ�ΪxmolL-1��CH3COOH��NaOH��Һ�������ϣ����Ϻ�ǡ������CH3COONa��CH3COONaΪǿ�������Σ�ˮ��ʼ��ԣ�����Һ�����ԣ������NaOH��Һ�����V1��20 mL����B��ȷ��
C����Һ�д��ڵ���غ㣺c(CH3COO-)+c(OH-)=c(H+)+c(Na+)��a��ʱ��Һ��pH=7����c(OH-)=c(H+)������c(CH3COO-)=c(Na+)����C��ȷ��
D��������NaOH��Һ�����Ϊ20mLʱ��ǡ�÷�Ӧ����CH3COONa����Һ�д��������غ㣺c(CH3COO-)+c(CH3COOH)=c(Na+)�����ڵ���غ㣺c(CH3COO-)+c(OH-)=c(H+)+c(Na+)����֪��ʽ�ɵã�c(OH-)=c(H+)+c(CH3COOH)����D����
�ʴ�ΪD��


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cu��Fe2O3�Ļ�����м���400 mL 1 mol��L��1�����ᣬǡ��ʹ�������ȫ�ܽ⣬������Һ�в���Fe3�������ù�����CO�ڸ����»�ԭ��ͬ������ԭ����������ٵ�����Ϊ
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(Li3N)���л��ϳɵĴ�����Li3N��ˮ���ҷ�Ӧ��ijС�����ʵ���Ʊ�����﮲��ⶨ�䴿�ȣ�װ����ͼ��ʾ��
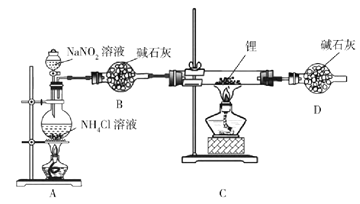
ʵ������NH4Cl��Һ��NaNO2��Һ�����Ʊ�N2��
��1��ʢװNH4Cl��Һ������������___________��
��2����ȫ©���С���ȫ��������__________��ʵ���ҽ�ﮱ�����_____���ú�͡���ʯ���͡���ˮ�����С�
��3��д���Ʊ�N2�Ļ�ѧ����ʽ__________��
��4��Dװ�õ�������____________��
��5���ⶨLi3N��Ʒ���ȣ�ȡmg Li3N��Ʒ����ͼ��ʾװ��ʵ�顣
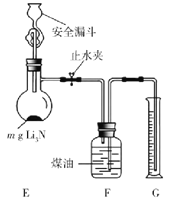
��ֹˮ�У���ȫ©���м�������ˮ����Li3N��ȫ��Ӧ��ƽF��G��Һ�棬���NH3���ΪVL�����ۺϳɱ�״������
�ٶ���ǰ��ƽF��G��Һ���Ŀ����ʹ�ռ�NH3�Ĵ���ѹ________������ڡ���С�ڡ����ڡ���������ѹ��
�ڸ�Li3N��Ʒ�Ĵ���Ϊ________%��ֻ�г���m��V�ļ���ʽ�����ؼ��㻯���� Li3N��Ʒ����Li�����ô���_____________��ѡ�ƫ�ߡ���ƫ�͡�����Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԻ�ѧ��Ӧ�����˵������ȷ����
A.ͬһ���ʵĹ̡�Һ��������״̬����ֵ�ݼ�
B.�����·�Ӧ2Na2SO3(s)+O2(g)=2Na2SO4(s�����Է����У�����H<0
C.CaCO3(s)=CaO(s)+CO2(g����H>0����S>0�������ں��������¶��������Է�
D.��Ϊ�ʱ���ر䶼�뷴Ӧ���Է����йأ�����ʱ���ʱ�����Ե�����Ϊ�жϷ�Ӧ�ܷ��Է����е��о�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���( )
A.ϴ������ʱ�ȵĴ�����Һ����Ĵ�����ҺЧ����
B.ʵ�������ű���ʳ��ˮ���ռ�����
C.����ˮƿ�����ݴ���Һ��ð��
D.2NO2(g)![]() N2O4(g)����ϵ�У���ѹ��С�������ɫ����������ʾ���淴Ӧ
N2O4(g)����ϵ�У���ѹ��С�������ɫ����������ʾ���淴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O5��һ����������������һ���¶��¿ɷ������·�Ӧ��2N2O5(g��![]() 4NO2(g)��O2(g����H��0��һ���¶�ʱ�����ܱ�������ͨ��N2O5������ʵ�����ݼ��±���
4NO2(g)��O2(g����H��0��һ���¶�ʱ�����ܱ�������ͨ��N2O5������ʵ�����ݼ��±���
ʱ��/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
����˵���д������
A.500 sʱO2��Ũ��Ϊ0.075 mol/L
B.ƽ��������¶ȣ�����Ӧ������������С
C.ƽ���Ҫʹƽ�ⳣ�����ı�������������¶�
D.1000 sʱ�������������Сһ�룬���´ﵽƽ��ʱ0.25 mol/L��c(N2O5)��0.50 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����з����������(����)
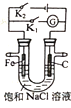
A.ֻ�պ�K2����װ�ý�����ת��Ϊ��ѧ��
B.ֻ�պ�K1��ʯī����Χ��ҺpH������
C.ֻ�պ�K2���������ᱻ��ʴ��������������������������
D.ֻ�պ�K1��Fe�缫������Ӧ��Fe��2e��=Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ag2SO4��KWΪ2.0��10-3��������Ag2SO4��������100 mLˮ�����պñ��ͣ��ù�����Ag+��SO42-Ũ����ʱ��仯��ϵ����ͼ������Ag2SO4��Һ��c(Ag+)��0.034 mol��L-1������t1ʱ����������ϵ�м���100 mL. 0.020 mol��L-1Na2SO4��Һ������ʾ��ͼ�У�����ȷ��ʾt1ʱ�̺�Ag+��SO42-Ũ����ʱ��仯��ϵ���ǣ� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A-F Ϊ��ѧ��ѧ�������ʣ����ǵ���ɫ�����Ϊ��ɫ������ A Ϊ���ʣ� B �� C�����Ԫ����ͬ���� B Ϊ����ɫ���壻 D�� E�� F ����Һ���Լ��ԣ����� E �� F ����������ͬ���ʵ���Ũ�ȵ���Һ�� E��Һ�ļ��Ը�ǿ������֮����ת����ϵ����ͼ������![]() ����ʾ��һ����Ӧ����ת�������ַ�Ӧ�������ͷ�Ӧ��������ȥ��
����ʾ��һ����Ӧ����ת�������ַ�Ӧ�������ͷ�Ӧ��������ȥ��
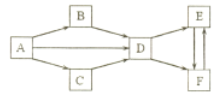
��ش��������⣺
��1��д���������ʵĻ�ѧʽ�� B___�� C___�� E___��
��2��A![]() D �Ļ�ѧ����ʽ��_______________________��
D �Ļ�ѧ����ʽ��_______________________��
��3��B![]() D �Ļ�ѧ����ʽ��_______________________��
D �Ļ�ѧ����ʽ��_______________________��
��4������ E �� F ���ֹ���ķ����ǣ��ֱ�ȡ������ E �� F ���ֹ����������Թ��У�����IJ�������ͽ�����_________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com