
����Ŀ�����жԻ�ѧ��Ӧ�����˵������ȷ����
A.ͬһ���ʵĹ̡�Һ��������״̬����ֵ�ݼ�
B.�����·�Ӧ2Na2SO3(s)+O2(g)=2Na2SO4(s�����Է����У�����H<0
C.CaCO3(s)=CaO(s)+CO2(g����H>0����S>0�������ں��������¶��������Է�
D.��Ϊ�ʱ���ر䶼�뷴Ӧ���Է����йأ�����ʱ���ʱ�����Ե�����Ϊ�жϷ�Ӧ�ܷ��Է����е��о�
���𰸡�B
��������
A. ͬһ���ʵĹ̡�Һ��������״̬����ֵ������A�����
B. �����·�Ӧ2Na2SO3(s)+O2(g)=2Na2SO4(s) ��S��0�����Է�������Ҫ����Ϊ��H<0��B����ȷ��
C. CaCO3(s)=CaO(s)+CO2(g����H>0����S>0�������������оݿ�֪�����Է����У���![]() ���������¿��Է����У�C�����
���������¿��Է����У�C�����
D. �ʱ���ر䶼�뷴Ӧ���Է����йأ����ʱ���ʱ䵥����Ϊ�жϷ�Ӧ�ܷ��Է����е��о���Ƭ��ģ�Ӧ���ø����оݣ���![]() ���ۺ��жϣ�D�����
���ۺ��жϣ�D�����
��ѡB��
��ѧ��Ӧ�ܷ��Է����У�ȡ�����ʱ���ر���ۺ��оݣ���![]() ʱ����Ӧ���Է����С�
ʱ����Ӧ���Է����С�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������������漰�ķ�Ӧ���£�
Na2Cr2O7��2C![]() Cr2O3��Na2CO3��CO��
Cr2O3��Na2CO3��CO��
Cr2O3��2Al![]() 2Cr��Al2O3
2Cr��Al2O3
(1) Cr��̬ԭ�ӵĺ�������Ų�ʽΪ________��

(2) Na��O��C�ĵ�һ�����ܴӴ�С��˳��Ϊ________��
(3) ��CO![]() ��Ϊ�ȵ������һ�ַ���Ϊ________(�ѧʽ)��
��Ϊ�ȵ������һ�ַ���Ϊ________(�ѧʽ)��
(4) Cr2O3�������ԣ�����NaOH��Һ�γ������Na[Cr(OH)4]��
Na[Cr(OH)4]������Ļ�ѧʽΪ____________��1 mol��������к�������ĿΪ_________��
(5) �Ͻ�CrAl����ľ�������ͼ��ʾ��д���úϽ�Ļ�ѧʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǽ������ϡ��������Ϻ��л��߷��Ӳ��ϲ���Ϊ������ϣ��Ƿ�չ���¼����Ļ�ʯ����δ���Ƽ���չ�з�������Ҫ�����á�
��1��Nierite��һ�ָ��۵��Ӳ�ȵ��մɲ��ϡ�Nierite��Ħ������Ϊ140 g/mol�����й�Ԫ�ص���������Ϊ60%����֪1 mol NH3��������SiCl4��ַ�Ӧ��ɵõ�35 g Nierite��3 mol HCl���塣Nierite�Ļ�ѧʽΪ___________��
��2��K���dz����Ĺ�������ϣ����ƽ��⣬����������ͭ�е�һ�ֻ����ֽ�����Ϊ�ⶨij18K����Ʒ����ɣ���2��832 g��Ʒ�����Ͷ��������Ũ�����У�����ȫ���ܽ���ռ���NO2��N2O4�Ļ������224 mL����������״������ͬ�������û��������84 mL O2��Ϻ�ͨ��ˮ�У�ǡ�ñ���ȫ���ա�
��д��18K��ijɷֱ�����ȷ��0��01%���������ý�������0����
18K��ɷ� | Au | Ag |
���������������� | 75��00% | _________ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����Ӧ![]() Fe2O3��s��+CO��g��
Fe2O3��s��+CO��g��![]() Fe��s��+CO2��g��H<0����1000���ƽ�ⳣ������4.0����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⣮
Fe��s��+CO2��g��H<0����1000���ƽ�ⳣ������4.0����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⣮
��1��CO��ƽ��ת����= ______ ��
��2�������CO��ƽ��ת���ʣ��ٽ�Fe2O3��ת�����ɲ�ȡ�Ĵ�ʩ�� ______
a����߷�Ӧ�¶� b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ��� d����ʱ���ջ��Ƴ�����CO2
e�������ʯ��ʹ����ƽ���������ֽӴ�
II����1����¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ�������º�H2��Ӧ�Ʊ��״��� CO��g��+2H2��g��CH3OH��g���������ͼʾ�ش��������⣺
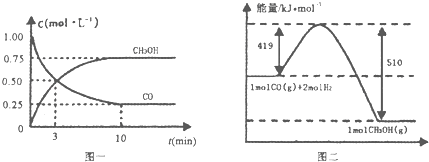
��1���ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v��H2��= ______ ��
��2�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
���� | ��Ӧ��Ͷ����� | ��Ӧ���ת���� | CH3OH��Ũ�� | �����仯 ��Q1��Q2��Q3������0�� |
�� | 1molCO��2molH2 | a1 | c1 | �ų�Q1kJ���� |
�� | 1molCH3OH | a2 | c2 | ����Q2kJ���� |
�� | 2molCO��4molH2 | a3 | c3 | �ų�Q3kJ���� |
�����й�ϵ��ȷ���� ______ ��
A c1=c2 B 2Q1=Q3 C 2a1=a3 D a1+a2=1 E �÷�Ӧ������1molCH3OH����ų���Q1+Q2��kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA�ǰ����ӵ�������ֵ������˵����ȷ����
A.16.25g FeCl3ˮ���γɵ�Fe(OH)3����������Ϊ0.1NA
B.92.0g ����(������)�к����ǻ���Ϊ1.0NA
C.22.4L(��״��)������е�������Ϊ18NA
D.1.0mol CH4��Cl2�ڹ����·�Ӧ���ɵ�CH3Cl������Ϊ1.0NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
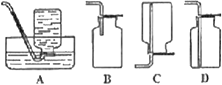
����Ŀ����ͼ����ѧ��ѧʵ���г������Ʊ����岢����ijЩ���ʵļ��������ʵ���װ�ã�A���Ʊ������װ�ã�C��D��E��F��ʢװ��Һ�������ͬ��Ҳ���ܲ�ͬ���Իش�

��1�����A�еĹ���������̼����Һ©����ʢװ����Ũ���ᣬ��д�������Ļ�ѧ��Ӧ����ʽ��____����Ҫ�������ɵIJ����B��C��D��E��F��Ӧ�ֱ������Լ�Ϊ__��__��__��__��__��E���Լ���C����ͬ��E���Լ����������__��Bװ�ó��ɼ��ij�����⣬������__���á�
��2������������ʵ��ʱ��F�еõ�10.0 g���壬��A�з�����Ӧת�Ƶĵ�����Ϊ__����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ�����Ʊ���Ȳ������������֤��װ��(�г���������ȥ)��

��1��ʵ�鿪ʼǰ�����Ƚ��еIJ�����___��
��2��ʵ�����Ƹ���Ȳ�ķ���ʽΪ___��
��3������A�ڰ�װǰ������еIJ�����___��Ϊ��ֹ�������ɵ����ʹ��죬��A����B���Լ�Ϊ___��
��4��װ��C��ѡ�õ��Լ�Ϊ___(д��һ�ּ���)��������Ϊ___��
��5����Ӧ��ʼ��D�е�����Ϊ___����������Ӧ�ķ�Ӧ����Ϊ___��
��6��D����֤ʵ�������B�з�Ӧ���ڼ�������ʱ�ɳ�ȥװ��D����װ��C֮�������ռ�װ�ã�����װ�������ʺ������ռ���Ȳ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���(Re)���۵�ͷе�ϸߵĽ�������֮һ�����������Ч����������ͻ�����档�ӻ�����������պ���̵���(��Ҫ�ɷ���SiO2��Re2O7��MoO3��CuO��Fe3O4)����ȡ覆۵�������ͼ��
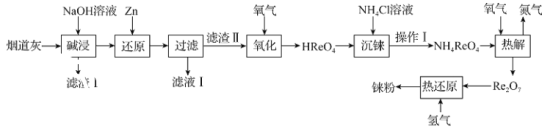
��֪��
I.�����(HReO4)��������ˮ��һԪǿ�ᣬ��������ǿ�����ԡ�
II.������(NH4ReO4)�ǰ�ɫƬ״���壬������ˮ��������ˮ��
�ش��������⣺
��1���������ʱ��Re2O7��MoO3��NaOH�������·�Ӧ��Re2O7+2NaOH=2NaReO4+H2O��MoO3+2NaOH=Na2MoO4+H2O����������I���ijɷ�Ϊ___��
��2��������ԭ��ʱ��Zn��������ZnO![]() ��NaReO4����ԭ�������ܵ�2ReO2��2H2O���÷�Ӧ�����ӷ���ʽΪ___��
��NaReO4����ԭ�������ܵ�2ReO2��2H2O���÷�Ӧ�����ӷ���ʽΪ___��
�ڷֱ���20���60�������½�������ԭ��ʱ����Һ��Re��Zn�ĺ����仯��ͼ��������ʾ����������ʱ��Ի�ԭ��Ӧ��Ӱ�죬����ԭ��ʱ�����ѡ����¶�Ϊ___��

��3��ͨ����������������ʱ���������м�ѹ��Ŀ����___����������ʱ��������376.5g����ᣬ���������ı�״�������������Ϊ___ L��
��4���������ʱ��������NH4Cl��Һ��������ɫ������Ϊʹ�����������������õ�����NH4ReO4���壬������I������___��ϴ�ӡ����
��5��Ϊ���蝹Ĵ��ȣ����������õ���NH4ReO4������ᴿ���ᴿ���õķ�����___��
��6�����Ƚ���ʱ��������Ӧ�Ļ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)2017���п�Ժij�о��Ŷ�ͨ�����һ������Na-Fe3O4/HZSM-5��ܸ��ϴ������ɹ�ʵ����CO2ֱ�Ӽ�����ȡ����ֵ���ͣ����о��ɹ�������Ϊ��CO2��ת�������ͻ���Խ�չ����
��֪��H2(g)+1/2O2(g)=H2O(l) ��H1 = ��aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ��H2= ��bKJ/mol
��д��25����101kPa�����£�CO2��H2��Ӧ��������(��C8H18��ʾ)���Ȼ�ѧ����ʽ_________________________________��
(2)����CO2��H2Ϊԭ�ϣ��ں��ʵĴ���(��Cu/ZnO����)�����£�Ҳ�ɺϳ�CH3OH���漰�ķ�Ӧ�У�
�ף�CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H= �� 53.7kJ��mol-1 ƽ�ⳣ��K1
CH3OH(g)+H2O(g) ��H= �� 53.7kJ��mol-1 ƽ�ⳣ��K1
�ң�CO2(g)+H2(g) ![]() CO(g)+H2O(g) ��H= + 41.2kJ��mol-1 ƽ�ⳣ��K2
CO(g)+H2O(g) ��H= + 41.2kJ��mol-1 ƽ�ⳣ��K2
��CO(g)+2H2(g) ![]() CH3OH(g)��ƽ�ⳣ��K=______(�ú�K1��K2�ı���ʽ��ʾ)���÷�Ӧ��H_____0(��������������С����)��
CH3OH(g)��ƽ�ⳣ��K=______(�ú�K1��K2�ı���ʽ��ʾ)���÷�Ӧ��H_____0(��������������С����)��
�����CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ��___________(��д����)��
�۴����ͷ�Ӧ��ϵ�Ĺ�ϵ��������Կ�Ĺ�ϵһ�������и߶ȵ�ѡ���ԡ���������ʵ�飬����CO2��H2��ʼͶ�ϱȾ�Ϊ1��2.2��������ͬ��Ӧʱ��(t1min)��
�¶�(K) | ���� | CO2ת����(%) | �״�ѡ����(%) | �ۺ�ѡ�� |
543 | Cu/ZnO���װ����� | 12.3 | 42.3 | A |
543 | Cu/ZnO����Ƭ���� | 11.9 | 72.7 | B |
553 | Cu/ZnO���װ����� | 15.3 | 39.1 | C |
553 | Cu/ZnO����Ƭ���� | 12.0 | 70.6 | D |
�ɱ����е����ݿ�֪����ͬ�¶��²�ͬ�Ĵ�����CO2��ת��ΪCH3OH��ѡ����������Ӱ�죬�����ϱ��������ݽ�Ϸ�Ӧԭ������������ѡ��Ϊ___________(����ĸ����)��
(3)��CO��H2Ϊԭ�Ϻϳ��״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g)���������Ϊ2L�����������ܱ����������������У��ֱ���1molCO��2molH2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣��ͼΪ���������еķ�Ӧ�����е�5minʱH2���������ʾ��ͼ��������һ��������Ӧһ���ﵽƽ��״̬��
CH3OH(g)���������Ϊ2L�����������ܱ����������������У��ֱ���1molCO��2molH2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣��ͼΪ���������еķ�Ӧ�����е�5minʱH2���������ʾ��ͼ��������һ��������Ӧһ���ﵽƽ��״̬��
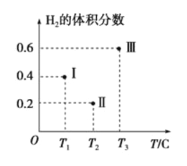
��0��5minʱ��������������CH3OH��ʾ�Ļ�ѧ��Ӧ����Ϊ_________________��
������������һ���ﵽƽ��״̬��������________(��д��������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com