
【题目】如图为实验室制备乙炔并进行性质验证的装置(夹持仪器己略去)。

(1)实验开始前,首先进行的操作是___;
(2)实验室制各乙炔的方程式为___;
(3)仪器A在安装前必须进行的操作是___,为防止气体生成的速率过快,由A滴入B的试剂为___。
(4)装置C可选用的试剂为___(写出一种即可),其作用为___;
(5)反应开始后,D中的现象为___,所发生反应的反应类型为___;
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___。
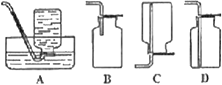
【答案】检查装置的气密性 CaC2+2H2O![]() Ca(OH)2+C2H2↑ 检查分液漏斗是否漏液 饱和食盐水 NaOH溶液或CuSO4溶液 除去气体中的杂质 溴水褪色 加成反应 A
Ca(OH)2+C2H2↑ 检查分液漏斗是否漏液 饱和食盐水 NaOH溶液或CuSO4溶液 除去气体中的杂质 溴水褪色 加成反应 A
【解析】
实验室中为缓解此反应的速率,常用饱和食盐水代替水反应制取,碳化钙CaC2与水反应生成氢氧化钙和乙炔,方程式为:CaC2+2H2O ![]() Ca(OH)2+C2H2↑,乙炔中常混有杂质气体硫化氢等,硫化氢与硫酸铜反应生成硫化铜沉淀;乙炔中含有碳碳三键,与溴发生加成反应。
Ca(OH)2+C2H2↑,乙炔中常混有杂质气体硫化氢等,硫化氢与硫酸铜反应生成硫化铜沉淀;乙炔中含有碳碳三键,与溴发生加成反应。
(1)反应前要检查装置的气密性;
(2) 碳化钙CaC2与水反应生成氢氧化钙和乙炔,方程式为:CaC2+2H2O ![]() Ca(OH)2+C2H2↑;
Ca(OH)2+C2H2↑;
(3)安装分液漏斗前要检查分液漏斗是否漏液,实验室中为缓解此反应的速率,常用饱和食盐水代替水反应制取;
(4)乙炔中常混有杂质气体硫化氢等,硫化氢与硫酸铜或反应生成硫化铜沉淀,或者和NaOH溶液反应;
(5)乙炔中含有碳碳三键,与溴发生加成反应,溴水褪色;
(6)乙炔不溶于水,乙炔相对分子质量26,与空气29接近,因此不宜使用排空气法,最好用排水法收集。


科目:高中化学 来源: 题型:
【题目】已知有以下物质的相互转化:

试回答:
(1)B的化学式为_____;D的化学式为_____。
(2)写出由E转变成F的化学方程式:______。
(3)常用____(填试剂名称)检验G中的阳离子,其现象为______。
(4)向G溶液中加入A的有关反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是( )
A.在![]() 内,Ⅰ中M的分解速率为
内,Ⅰ中M的分解速率为![]()
B.水样酸性越强,M的分解速率越快
C.在![]() 内,Ⅲ中M的分解百分率比Ⅱ大
内,Ⅲ中M的分解百分率比Ⅱ大
D.由于![]() 存在,Ⅳ中M的分解速率比Ⅰ快
存在,Ⅳ中M的分解速率比Ⅰ快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学反应方向的说法,正确的是
A.同一物质的固、液、气三种状态的熵值递减
B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都不可能自发
D.因为焓变和熵变都与反应的自发性有关,因此焓变或墒变均可以单独做为判断反应能否自发进行的判据
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是
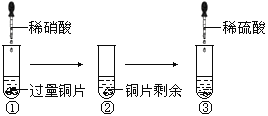
A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
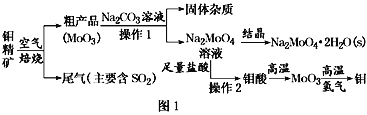
已知:钼酸微溶于水,可溶于液碱和氨水。
回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为_____________________________。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是___________________,请提出一种实验室除去该尾气的方法____________________________________。
(3)操作2的名称为________。由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是________。
(4)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
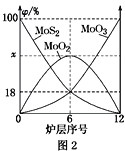
①x=________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的化学式及物质的量分别为________、________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学反应因条件不同,可生成不同的产物。例如:
CH3-CH=CH2+HX (X为卤素原子)
(X为卤素原子)
工业上按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。

请回答下列问题:
(1)反应①的反应类型:___反应;
(2)反应③的反应条件为:___;
(3)写出B结构简式:___;
(4)由C生成D的化学方程式:___;
(5)D物质有多种同分异构体,请写出两种符合下列条件的有机物的结构简式:___、___。
a.其水溶液遇FeCl3溶液变紫色
b.分子中有苯环,且苯环上的一溴代物有2种
(6)根据上述合成路线和所学知识,写出由2—氯丙烷制取丙醛的合成路线,无机试剂任选。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+![]() O2(g)=H2O(g),反应过程中能量变化如图所示,请回答下列问题。
O2(g)=H2O(g),反应过程中能量变化如图所示,请回答下列问题。

(1)a、c分别代表什么意义?
a:____________________;c:____________________。
(2)该反应ΔH_________(填“>”“<”或“=”)0。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com