
����Ŀ���������ڹ�ҵ��������������Ҫ�����á���(Mo)�ij������ϼ�Ϊ+6��+5��+4�����⾫��(��Ҫ�ɷ���MoS2)���Ʊ�������������ƾ���(Na2MoO4��2H2O)������������ͼ1��ʾ��
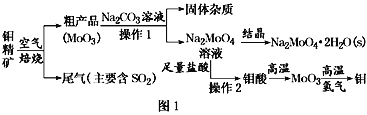
��֪����������ˮ��������Һ��Ͱ�ˮ��
�ش��������⣺
��1�������⾫��ʱ�����Ļ�ѧ����ʽΪ_____________________________��
��2���⾫����ʱ�ŷŵ�β���Ի�������ҪΣ����___________________�������һ��ʵ���ҳ�ȥ��β���ķ���____________________________________��
��3������2������Ϊ________��������õ�MoO3���õ��Ĺ����β���������������________��
��4�������⾫�����õ�װ���Ƕ�㱺��¯��ͼ2Ϊ��¯��������ϵ����ʵ����İٷ���(��)��
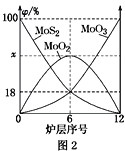
��x��________��
������¯��Ҳ�ᷢ��MoS2��MoO3��Ӧ����MoO2��SO2�ķ�Ӧ�����÷�Ӧת��6mol���ӣ������ĵ��������Ļ�ѧʽ�����ʵ����ֱ�Ϊ________��________��
��5������1�У�����̼������Һ��ַ�Ӧ���Һ��c(MoO42-)��0.80mol��L1��c(SO42-)��0.04 mol��L1���ڽᾧǰ�����Ba(OH)2�����Գ�ȥ��Һ�е�SO42-����BaMoO4��ʼ����ʱ��SO42-��ȥ������________��[Ksp(BaSO4)��1.1��1010��Ksp(BaMoO4)��4.0��108����Һ����仯�ɺ��Բ���]
���𰸡�2MoS2 + 7O2![]() 2MoO3 + 4SO2 �γ����� ���ð�ˮ������������Һ����(���������𰸾���) ���� ���� 64 MoO3 3mol 94.5%
2MoO3 + 4SO2 �γ����� ���ð�ˮ������������Һ����(���������𰸾���) ���� ���� 64 MoO3 3mol 94.5%
��������
�⾫��(��Ҫ�ɷ���MoS2)�������⾫��Ӧ�Ļ�ѧ����ʽΪ2MoS2+7O2 ![]() 2MoO3+4SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ����ʽΪMoO3+CO32-=MoO42-+CO2������Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ���õ�Na2MoO4��2H2O��Na2MoO4���������ᷴӦ�������ᣬ��������ˮ�����˵õ����ᣬ����������������MoO3�������£���������ԭMoO3�õ�Mo���ݴ˷������
2MoO3+4SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ����ʽΪMoO3+CO32-=MoO42-+CO2������Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ���õ�Na2MoO4��2H2O��Na2MoO4���������ᷴӦ�������ᣬ��������ˮ�����˵õ����ᣬ����������������MoO3�������£���������ԭMoO3�õ�Mo���ݴ˷������
(1)�⾫��(��Ҫ�ɷ���MoS2)������ʱ��MoS2����������Ӧ����MoO3ͬʱ���ɶ�������2MoS2+7O2 ![]() 2MoO3+4SO2���ʴ�Ϊ��2MoS2+7O2
2MoO3+4SO2���ʴ�Ϊ��2MoS2+7O2 ![]() 2MoO3+4SO2��
2MoO3+4SO2��
(2)�⾫����ʱ�ŷŵ�β���к��ж��������γ����ꣻ��������Ϊ������������ð�ˮ������������Һ���գ��ʴ�Ϊ���γ����ꣻ���ð�ˮ������������Һ���գ�
(3)��������ͼ������2�Ǵ�Na2MoO4�����ᷴӦ�����Һ�еõ����ᣬ��������ˮ���ù��˷���õ�����������·ֽ�õ�MoO3��Ҫ�������н��У��ʴ�Ϊ�����ˣ�������
(4)����ͼ2��֪���ڵ�6¯���д��ڵĹ������ʷֱ�ΪMoS2��MoO3��MoO2������MoS2��MoO3�����ʵ����ٷֱȾ�Ϊ18%������MoԪ���غ㣬��MoO2 �����ʵ����ٷֱ�Ϊ1-18%-18%=64%����xΪ64���ʴ�Ϊ��64��
��MoS2��MoO3��Ӧ����MoO2��SO2�ķ�ӦΪ��MoS2+6MoO3 ![]() 7MoO2+2SO2������MoS2��MoԪ�ػ��ϼ۲��䣬SԪ����-2���ߵ�+4�ۣ�������������ԭ����MoO3��MoԪ�ػ��ϼ���+6�۽��͵�+4�ۣ�����ԭ������������6mol������MoO3��Ӧת�Ƶ���12mol�����÷�Ӧת��6mol���ӣ������ĵ�MoO33mol���ʴ�Ϊ��MoO3��3mol��
7MoO2+2SO2������MoS2��MoԪ�ػ��ϼ۲��䣬SԪ����-2���ߵ�+4�ۣ�������������ԭ����MoO3��MoԪ�ػ��ϼ���+6�۽��͵�+4�ۣ�����ԭ������������6mol������MoO3��Ӧת�Ƶ���12mol�����÷�Ӧת��6mol���ӣ������ĵ�MoO33mol���ʴ�Ϊ��MoO3��3mol��
(5)c(MoO42-)=0.80molL-1��c(SO42-)=0.04molL-1����BaMoO4��ʼ����ʱ��c(Ba2+)=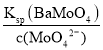 =
=![]() molL-1=5.0��10-8molL-1����ʱc(SO42-)=
molL-1=5.0��10-8molL-1����ʱc(SO42-)=![]() molL-1=2.2��10-3molL-1��SO42-��ȥ����=
molL-1=2.2��10-3molL-1��SO42-��ȥ����=![]() ��100%=94.5%���ʴ�Ϊ��94.5%��
��100%=94.5%���ʴ�Ϊ��94.5%��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ӻͱ�ͪ������Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ���������������������Ӻͱ�ͪ���䷴Ӧ��������ʾ��ͼ���£������й�˵����ȷ����( )
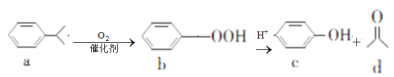
A.a��b��c�����ڷ�����B.a��d������̼ԭ�Ӿ�����ͬһƽ����
C.a��9�����ڷ������ͬ���칹��D.c��d���ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA�ǰ����ӵ�������ֵ������˵����ȷ����
A.16.25g FeCl3ˮ���γɵ�Fe(OH)3����������Ϊ0.1NA
B.92.0g ����(������)�к����ǻ���Ϊ1.0NA
C.22.4L(��״��)������е�������Ϊ18NA
D.1.0mol CH4��Cl2�ڹ����·�Ӧ���ɵ�CH3Cl������Ϊ1.0NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
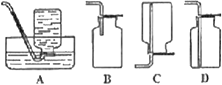
����Ŀ����ͼΪʵ�����Ʊ���Ȳ������������֤��װ��(�г���������ȥ)��

��1��ʵ�鿪ʼǰ�����Ƚ��еIJ�����___��
��2��ʵ�����Ƹ���Ȳ�ķ���ʽΪ___��
��3������A�ڰ�װǰ������еIJ�����___��Ϊ��ֹ�������ɵ����ʹ��죬��A����B���Լ�Ϊ___��
��4��װ��C��ѡ�õ��Լ�Ϊ___(д��һ�ּ���)��������Ϊ___��
��5����Ӧ��ʼ��D�е�����Ϊ___����������Ӧ�ķ�Ӧ����Ϊ___��
��6��D����֤ʵ�������B�з�Ӧ���ڼ�������ʱ�ɳ�ȥװ��D����װ��C֮�������ռ�װ�ã�����װ�������ʺ������ռ���Ȳ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��FeCl3��Ч���Ҹ�ʴ��С����ش��������⣺
(1)FeCl3��ˮ��ԭ����______��FeCl3��Һ��ʴ�����豸����H�������⣬��һ��Ҫԭ����(�����ӷ���ʽ��ʾ)______��
(2)Ϊ��Լ�ɱ�����ҵ����NaClO3��������FeCl2��Һ�õ�FeCl3��
��������FeCl2��Һ��c(Fe2��)=2.0��10-2mol��L-1��c(Fe3��)=1.0��10-3mol��L-1��c(Cl��)=5.3��10-2mol��L-1�������Һ��pHԼΪ______��
�����NaClO3����FeCl2�����ӷ���ʽ��
___![]() +___Fe2++___=___Cl+___Fe3++__
+___Fe2++___=___Cl+___Fe3++__
(3)FeCl3����Һ�з�����ˮ�⣺
Fe3��+H2O![]() Fe(OH)2++H�� K1
Fe(OH)2++H�� K1
Fe(OH)2++H2O![]()
![]() +H�� K2
+H�� K2
![]() +H2O
+H2O![]() Fe(OH)3+H�� K3
Fe(OH)3+H�� K3
����ˮ�ⷴӦ��ƽ�ⳣ��K1��K2��K3�ɴ�С��˳����__________��
ͨ����������������ˮ�����ۺϣ����ɾۺ������������ӷ���ʽΪ��xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+����ʹƽ�������ƶ��ɲ��õķ�����(�����)______��
Fex(OH)y(3x-y)++yH+����ʹƽ�������ƶ��ɲ��õķ�����(�����)______��
a������ b����ˮϡ��
c������NH4Cl d������NaHCO3
�����£�ʹ�Ȼ�����Һת��Ϊ��Ũ�Ⱦۺ��Ȼ����Ĺؼ�������___��
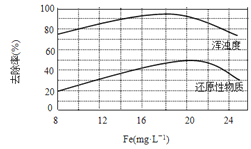
(4)���ij��ˮ���������Ȼ���������ˮ�Ľ������ͼ��ʾ����ͼ�����ݵó�ÿ����ˮ��Ͷ�žۺ��Ȼ���[��Fe(mg��L-1)��ʾ]����ѷ�ΧԼΪ_____mg��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
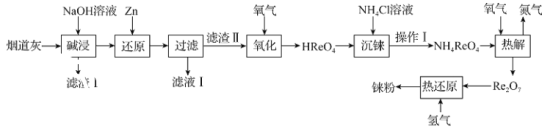
����Ŀ���(Re)���۵�ͷе�ϸߵĽ�������֮һ�����������Ч����������ͻ�����档�ӻ�����������պ���̵���(��Ҫ�ɷ���SiO2��Re2O7��MoO3��CuO��Fe3O4)����ȡ覆۵�������ͼ��
��֪��
I.�����(HReO4)��������ˮ��һԪǿ�ᣬ��������ǿ�����ԡ�
II.������(NH4ReO4)�ǰ�ɫƬ״���壬������ˮ��������ˮ��
�ش��������⣺
��1���������ʱ��Re2O7��MoO3��NaOH�������·�Ӧ��Re2O7+2NaOH=2NaReO4+H2O��MoO3+2NaOH=Na2MoO4+H2O����������I���ijɷ�Ϊ___��
��2��������ԭ��ʱ��Zn��������ZnO![]() ��NaReO4����ԭ�������ܵ�2ReO2��2H2O���÷�Ӧ�����ӷ���ʽΪ___��
��NaReO4����ԭ�������ܵ�2ReO2��2H2O���÷�Ӧ�����ӷ���ʽΪ___��
�ڷֱ���20���60�������½�������ԭ��ʱ����Һ��Re��Zn�ĺ����仯��ͼ��������ʾ����������ʱ��Ի�ԭ��Ӧ��Ӱ�죬����ԭ��ʱ�����ѡ����¶�Ϊ___��

��3��ͨ����������������ʱ���������м�ѹ��Ŀ����___����������ʱ��������376.5g����ᣬ���������ı�״�������������Ϊ___ L��
��4���������ʱ��������NH4Cl��Һ��������ɫ������Ϊʹ�����������������õ�����NH4ReO4���壬������I������___��ϴ�ӡ����
��5��Ϊ���蝹Ĵ��ȣ����������õ���NH4ReO4������ᴿ���ᴿ���õķ�����___��
��6�����Ƚ���ʱ��������Ӧ�Ļ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1mol��L-1������ζ�10mL0.1mol��L-1��Na2SO3��Һ���ζ�������ͼ��ʾ(�����ǵζ�������SO2���ݳ�)������˵��������ǣ� ��

A.a����ˮ�������������Ũ�ȴ���d����ˮ�������������Ũ��
B.0.05mol��L-1NaHSO3��Һ��pH=4.25
C.c��ʱ��c(Na+)>c(Cl-)>c(HSO![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.d��ʱ��c(H2SO3)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ��3X(g)��Y(g) ![]() 2Z(g)��2W(g)��2 L�ܱ������н��У�5 min��Y������0.5 mol����˷�Ӧ�ķ�Ӧ����Ϊ(����)
2Z(g)��2W(g)��2 L�ܱ������н��У�5 min��Y������0.5 mol����˷�Ӧ�ķ�Ӧ����Ϊ(����)
A.v(X)��0.05 mol��L��1��min��1B.v(Y)��0.10 mol��L��1��min��1
C.v(Z)��0.10 mol��L��1��min��1D.v(W)��0.10 mol��L��1��s��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com