
【题目】铼(Re)是熔点和沸点较高的金属单质之一,用于制造高效能喷射引擎和火箭引擎。从辉钼矿氧化焙烧后的烟道灰(主要成分有SiO2、Re2O7、MoO3、CuO、Fe3O4)中提取铼粉的流程如图:
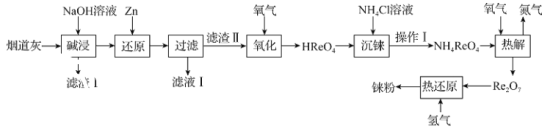
已知:
I.过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
II.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3与NaOH发生以下反应:Re2O7+2NaOH=2NaReO4+H2O;MoO3+2NaOH=Na2MoO4+H2O,则“滤渣I”的成分为___。
(2)①“还原”时,Zn被氧化成ZnO![]() ,NaReO4被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___。
,NaReO4被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___。
②分别在20℃和60℃条件下进行“还原”时,溶液中Re和Zn的含量变化如图中曲线所示,若不考虑时间对还原反应的影响,“还原”时,最好选择的温度为___。

(3)通氧气进行“氧化”时,往往进行加压,目的是___。“氧化”时,若生成376.5g过铼酸,理论上消耗标准状况下氧气的体积为___ L。
(4)“沉铼”时,加入热NH4Cl溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括___、洗涤、干燥。
(5)为提高铼的纯度,“过滤”得到的NH4ReO4需进行提纯,提纯所用的方法是___。
(6)“热解”时,发生反应的化学方程式为___。
【答案】CuO、Fe3O4 3Zn+2ReO![]() +4OH-=3ZnO
+4OH-=3ZnO![]() +2ReO2·2H2O 20℃ 增大氧气在溶液中的溶解度,加快氧化速率 25.2 冷却结晶、过滤 重结晶 4NH3ReO4+3O2
+2ReO2·2H2O 20℃ 增大氧气在溶液中的溶解度,加快氧化速率 25.2 冷却结晶、过滤 重结晶 4NH3ReO4+3O2![]() 2N2+8H2O+2Re2O7
2N2+8H2O+2Re2O7
【解析】
烟道灰经过NaOH溶液碱浸后,SiO2、Re2O7、MoO3发生反应,滤渣1中是CuO、Fe3O4。加Zn还原,发生反应3Zn+2ReO![]() +4OH-=3ZnO
+4OH-=3ZnO![]() +2ReO2+2H2O,过滤后得到ReO2·2H2O固体,经O2氧化后得到过铼酸(HReO4)。加入热NH4Cl溶液,经过冷却结晶、过滤、洗涤、干燥得到过铼酸铵(NH4ReO4),再与O2发生反应4NH3ReO4+3O2
+2ReO2+2H2O,过滤后得到ReO2·2H2O固体,经O2氧化后得到过铼酸(HReO4)。加入热NH4Cl溶液,经过冷却结晶、过滤、洗涤、干燥得到过铼酸铵(NH4ReO4),再与O2发生反应4NH3ReO4+3O2![]() 2N2+8H2O+2Re2O7,得到Re2O7,最后用H2还原氧化物得到金属Re。
2N2+8H2O+2Re2O7,得到Re2O7,最后用H2还原氧化物得到金属Re。
(1)“碱浸”时,Re2O7和MoO3与NaOH发生反应:Re2O7+2NaOH=2NaReO4+H2O;MoO3+2NaOH=Na2MoO4+H2O,SiO2与NaOH发生反应:SiO2+2NaOH=Na2SiO3+H2O,只有CuO、Fe3O4没有反应,故滤渣1是CuO、Fe3O4;
(2)①根据题意,Zn被氧化成ZnO![]() ,NaReO4被还原生成ReO2·2H2O,故离子方程式是3Zn+2ReO
,NaReO4被还原生成ReO2·2H2O,故离子方程式是3Zn+2ReO![]() +4OH-=3ZnO
+4OH-=3ZnO![]() +2ReO2·2H2O;
+2ReO2·2H2O;
②温度越高,反应速率越快,由图像可知,两条比较陡的曲线为60℃时的曲线,稍微缓和的曲线是20℃时的曲线。20℃的曲线最后的Re含量低,即得到的固体更多,不考虑时间因素,选择20℃;
(3)气体的溶解度随压强的增大而增大,加压可以增大氧气在溶液中的溶解度,即加大了O2的浓度,从而加快氧化速率;376.5g过铼酸的物质的量为![]() ,Re元素由ReO2中的+4价变为HReO4中的+7价,每个Re转移电子数为3,所以共转移电子
,Re元素由ReO2中的+4价变为HReO4中的+7价,每个Re转移电子数为3,所以共转移电子![]() ,每个O2转移4个电子,O2的物质的量为
,每个O2转移4个电子,O2的物质的量为![]() ,体积为
,体积为![]() ;(4)由分析可知,加入热NH4Cl溶液后需经冷却结晶、过滤操作;
;(4)由分析可知,加入热NH4Cl溶液后需经冷却结晶、过滤操作;
(5)过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水,提纯时可用热水溶解后冷却结晶,属于重结晶;
(6)由分析可知,NH3ReO4与O2反应生成N2和Re2O7,反应方程式为4NH3ReO4+3O2![]() 2N2+8H2O+2Re2O7;
2N2+8H2O+2Re2O7;


科目:高中化学 来源: 题型:
【题目】某研究小组制备84消毒液(主要成分NaClO)设计了如图装置。并查阅到下列资料:

Ⅰ.氯气与水的反应是放热反应;
Ⅱ.卤素单质与碱液发生反应:3X2+6OH-![]() 5X-+XO3-+3H2O。
5X-+XO3-+3H2O。
回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为__。
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?__(填“能”或“不能”,下同),理由是__。
(3)装置中能否省去盛浓硫酸的洗气瓶?__,理由是__。
(4)装置中能否省去盛冰水的烧杯?__,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学反应方向的说法,正确的是
A.同一物质的固、液、气三种状态的熵值递减
B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都不可能自发
D.因为焓变和熵变都与反应的自发性有关,因此焓变或墒变均可以单独做为判断反应能否自发进行的判据
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是
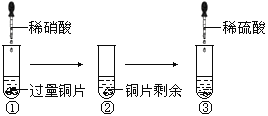
A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
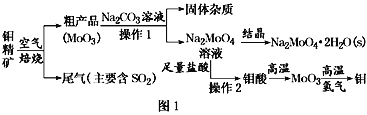
已知:钼酸微溶于水,可溶于液碱和氨水。
回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为_____________________________。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是___________________,请提出一种实验室除去该尾气的方法____________________________________。
(3)操作2的名称为________。由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是________。
(4)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
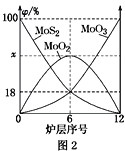
①x=________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的化学式及物质的量分别为________、________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氮化镁的装置如图所示。实验时在不锈钢舟内加入镁粉,通氮气15min,升温至1073K,加热半小时,冷却至室温,停止通氮气。下列说法正确的是( )
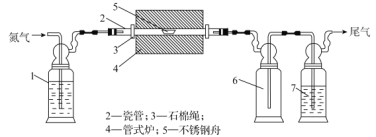
A.1中的试剂是饱和食盐水,便于观察气泡,调节气流速度
B.6的作用是缓冲加热后未反应的氮气,7的作用是防止空气中的水分进入装置
C.氮化镁是共价化合物,露置于空气中有刺激性气味的气体产生
D.实验中氮气是反应物,仅起到氧化镁粉的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学反应因条件不同,可生成不同的产物。例如:
CH3-CH=CH2+HX (X为卤素原子)
(X为卤素原子)
工业上按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。

请回答下列问题:
(1)反应①的反应类型:___反应;
(2)反应③的反应条件为:___;
(3)写出B结构简式:___;
(4)由C生成D的化学方程式:___;
(5)D物质有多种同分异构体,请写出两种符合下列条件的有机物的结构简式:___、___。
a.其水溶液遇FeCl3溶液变紫色
b.分子中有苯环,且苯环上的一溴代物有2种
(6)根据上述合成路线和所学知识,写出由2—氯丙烷制取丙醛的合成路线,无机试剂任选。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。

(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向密闭容器中充入30 mL CO和20 mL水蒸气,使其反应;当反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是
CO2(g)+H2(g)达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是
A. 平衡后CO的体积分数为40%
B. 平衡后CO的转化率为25%
C. 平衡后水的转化率为50%
D. 平衡后混合气体的平均相对分子质量为24
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com