
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是( )
A.在![]() 内,Ⅰ中M的分解速率为
内,Ⅰ中M的分解速率为![]()
B.水样酸性越强,M的分解速率越快
C.在![]() 内,Ⅲ中M的分解百分率比Ⅱ大
内,Ⅲ中M的分解百分率比Ⅱ大
D.由于![]() 存在,Ⅳ中M的分解速率比Ⅰ快
存在,Ⅳ中M的分解速率比Ⅰ快
【答案】D
【解析】
A. ![]() 内,浓度的变化量为0.4mol/L-0.10mol/L=0.3 mol/L,可计算速率;
内,浓度的变化量为0.4mol/L-0.10mol/L=0.3 mol/L,可计算速率;
B.由I、II两组的数据可得结果;
C. 在![]() 内,根据浓度的变化量和起始浓度,可计算分解百分率;
内,根据浓度的变化量和起始浓度,可计算分解百分率;
D.IV组在![]() 内,浓度的变化量为0.20mol/L-0.01mol/L=0.19 mol/L,可计算分解速率,再与I组做对比。
内,浓度的变化量为0.20mol/L-0.01mol/L=0.19 mol/L,可计算分解速率,再与I组做对比。
A. ![]() 内,浓度的变化量为0.4mol/L-0.10mol/L=0.3 mol/L,那么
内,浓度的变化量为0.4mol/L-0.10mol/L=0.3 mol/L,那么![]()
![]() ,A项正确;
,A项正确;
B.对比I、II两组的数据,I组![]() 内,浓度的变化量为0.4mol/L-0.10mol/L=0.3 mol/L,那么
内,浓度的变化量为0.4mol/L-0.10mol/L=0.3 mol/L,那么![]()
![]() ,II组
,II组![]() 内浓度的变化量为0.4mol/L-0.18mol/L=0.22 mol/L,那么
内浓度的变化量为0.4mol/L-0.18mol/L=0.22 mol/L,那么![]()
![]() ,可知酸性越大,分解速率越快,B项正确;
,可知酸性越大,分解速率越快,B项正确;
C. II组![]() 内浓度的变化量为0.4mol/L-0.18mol/L=0.22 mol/L,分解率为
内浓度的变化量为0.4mol/L-0.18mol/L=0.22 mol/L,分解率为![]() ,III组在
,III组在![]() 内,浓度的变化量为0.20mol/L-0.07mol/L=0.13 mol/L,分解率为
内,浓度的变化量为0.20mol/L-0.07mol/L=0.13 mol/L,分解率为 ![]() ,Ⅲ中M的分解百分率比Ⅱ大,C项正确;
,Ⅲ中M的分解百分率比Ⅱ大,C项正确;
D. IV组在![]() 内,分解速率为
内,分解速率为![]() ,I组
,I组![]() 内,分解速率为
内,分解速率为![]() ,故I的分解速率大于Ⅳ,D项错误;
,故I的分解速率大于Ⅳ,D项错误;
答案选D。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D 4种物质混合,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行一定时间后,测得A减少了4n mol,B减少了2n mol,C增加了6n mol,D增加了4n mol,此时达到化学平衡。
cC(s)+dD,当反应进行一定时间后,测得A减少了4n mol,B减少了2n mol,C增加了6n mol,D增加了4n mol,此时达到化学平衡。
(1)该化学方程式各物质的化学计量数为a=____、b=____、c=_____、d=____。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态: A_________、B_______、D________。
(3)若只升高温度,反应一段时间后,测知4种物质其物质的量又达到相等,则该反应为______(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下,下列有关说法正确的是( )
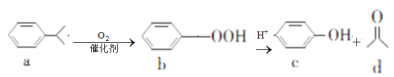
A.a、b、c均属于芳香烃B.a、d中所有碳原子均处于同一平面上
C.a有9种属于芳香族的同分异构体D.c、d均能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________。
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
18K金成分 | Au | Ag |
含量(质量分数) | 75.00% | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.反应![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
Fe(s)+CO2(g)H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率= ______ 。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 ______
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
II.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇: CO(g)+2H2(g)CH3OH(g)。请根据图示回答下列问题:
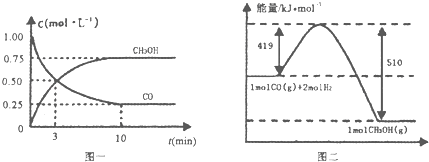
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ______ 。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
乙 | 1molCH3OH | a2 | c2 | 吸收Q2kJ热量 |
丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是 ______ .
A c1=c2 B 2Q1=Q3 C 2a1=a3 D a1+a2=1 E 该反应若生成1molCH3OH,则放出(Q1+Q2)kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.16.25g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.92.0g 甘油(丙三醇)中含有羟基数为1.0NA
C.22.4L(标准状况)氩气含有的质子数为18NA
D.1.0mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
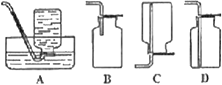
【题目】如图为实验室制备乙炔并进行性质验证的装置(夹持仪器己略去)。

(1)实验开始前,首先进行的操作是___;
(2)实验室制各乙炔的方程式为___;
(3)仪器A在安装前必须进行的操作是___,为防止气体生成的速率过快,由A滴入B的试剂为___。
(4)装置C可选用的试剂为___(写出一种即可),其作用为___;
(5)反应开始后,D中的现象为___,所发生反应的反应类型为___;
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com