
【题目】无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________。
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
18K金成分 | Au | Ag |
含量(质量分数) | 75.00% | _________ |
【答案】Si3N4 11.44%
【解析】
(1)确定Nierite有硅元素和氮元素,化学式中硅原子的个数为140×60%÷28=3,氮原子个数为140×40%÷14=4;
(2)设K金中含有铜银两种金属,则根据质量关系列等式为64n(Cu)+108n(Ag)=2.832×(1-75%),金与浓硝酸不反应,铜银与浓硝酸发生氧化还原反应,将HNO3还原为NO2和N2O4,NO2和N2O4的混合气与标准状况下84mLO2混合通入水中恰好被完全吸收获得HNO3,根据电子守恒,即Cu、Ag失去的电子总数等于O2得到的电子总数,2n(Cu)+n(Ag)= ![]() ,联立方程可以求出Ag的质量分数。
,联立方程可以求出Ag的质量分数。
(1)1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体,参与反应的SiCl4物质的量为(35g+3mol×36.5g/mol-1mol×17g/mol)÷170g/mol=0.75mol;则Nierite中有硅元素和氮元素,化学式中硅原子的个数为140×60%÷28=3,氮原子个数为140×40%÷14=4,故化学式为Si3N4;
(2)设K金中含有铜银两种金属,则根据质量关系列等式为64n(Cu)+108n(Ag)=2.832×(1-75%),金与浓硝酸不反应,铜银与浓硝酸发生氧化还原反应,将HNO3还原为NO2和N2O4,NO2和N2O4的混合气与标准状况下84mLO2混合通入水中恰好被完全吸收获得HNO3,根据电子守恒,即Cu、Ag失去的电子总数等于O2得到的电子总数,2n(Cu)+n(Ag)= ![]() ,二者联立解得n(Cu)=0.006mol,n(Ag)=0.003mol,Ag的质量分数为
,二者联立解得n(Cu)=0.006mol,n(Ag)=0.003mol,Ag的质量分数为![]() =11.44%,Cu的质量分数为25%-11.44%=13.56%。
=11.44%,Cu的质量分数为25%-11.44%=13.56%。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质B的质量分数减小了
C.物质A的转化率减小了
D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
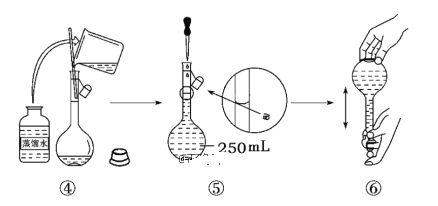
【题目】实验室需要0.2mol·L-1Na2CO3溶液250mL和0.5mol·L-1盐酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图是某同学用Na2CO3·10H2O配制0.2mol·L-1Na2CO3溶液250mL的过程,其中错误的步骤有___。(填实验操作序号)
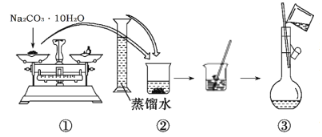
(2)根据计算,用托盘天平称取Na2CO3·10H2O的质量为__g。若定容时液面高于刻度线,应采取的措施是___。
(3)配制0.5mol·L-1盐酸溶液450mL 溶液需要玻璃仪器除烧杯、胶头滴管、量筒外还需要___。
(4)由计算知,该实验中配制0.5mol·L-1盐酸时需用量筒量取质量分数为36.5%、密度为1.2g/cm3的浓盐酸___mL。在实验中其它操作均正确,若定容时俯视刻度线,则所得盐酸溶液浓度___0.5mol·L-1(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
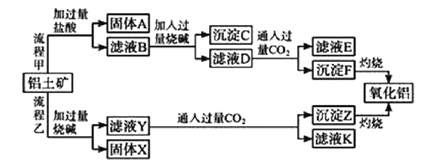
请回答下列问题:
(1)固体A的主要成分是______________(写名称)。
(2)铝土矿与过量烧碱反应的离子方程式为______________、________________。
(3)滤液D中的溶质有______________(填化学式)。
(4)指出流程乙的一个缺点是____________。
(5)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X。已知每转移6.02×1023个电子,有0.5mol化合物X生成,此反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
![]()
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
(1)A的电子式为___。
(2)在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为___。
(3)工业上常用过量的Na2CO3溶液吸收C,生成等物质的量的两种硝酸盐,该反应的离子方程式为___。
Ⅱ.若A、C、W都是常见气体,C是导致酸雨的主要气体,常温下A与C反应生成B,则该反应的化学方程式为___。某化学活动小组将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:____。
Ⅲ.A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
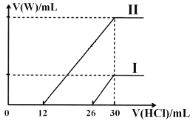
(1)若将标准状况下2.24L的W通入150mL1mol·L-1的A溶液中,充分反应。总反应的离子方程式为____。
(2)向两份30mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.2mol·L-1盐酸,如图所示,Ⅰ和Ⅱ分别为向M、N溶液中加入盐酸的体积V(HCl)与产生W气体的体积V(W)的关系。则M、N两溶液中相同溶质的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是


A. Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B. Ⅱ图中:闻Cl2的气味
C. Ⅲ图中:生成棕黄色的烟
D. Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.25℃时某溶液中水电离出的c(H+)=1.0×1012 mol·L1,其pH一定是12
B.某温度下,向氨水中通入CO2,随着CO2的通入,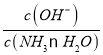 不断增大
不断增大
C.恒温恒容下,反应X(g)+3Y(g) ![]() 2Z(g),起始充入3 mol X和3 mol Y,当X的体积分数不变时,反应达到平衡
2Z(g),起始充入3 mol X和3 mol Y,当X的体积分数不变时,反应达到平衡
D.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,该温度下加入等体积pH=10的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ·mol-1
B. 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C. 在101k Pa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ·mol-1
D. 在稀溶液中,H+(aq)+OH-(aq)=H2O(l),![]() H=-57.3 kJ·mol-1。若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ
H=-57.3 kJ·mol-1。若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁烯与氯化氢可能发生的两种加成反应及相应的能量变化与反应过程如下图所示,下列说法错误的是( )


A.活化能:反应①大于反应②
B.中间产物的稳定性:中间体1小于中间体2
C.产物的能量:产物1大于产物2
D.△H大小:反应①小于反应②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com