
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质B的质量分数减小了
C.物质A的转化率减小了
D.a>b
【答案】A
【解析】
假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,则a<b,据此分析解答。
A.假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,大于原来的50%,说明平衡向生成B的方向移动,即向正反应移动,故A正确;
B.平衡向正反应移动,B的质量增大,混合气体的总质量不变,物质B的质量分数增大,故B错误;
C.根据A的判断,平衡向正反应移动,反应物转化率增大,故C错误;
D.容器体积扩大一倍,则体系压强减小,根据A的判断,平衡向生成B的方向移动,则a<b,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
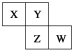
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性Z比W强
C. Y的气态氢化物的稳定性较Z的弱
D. 四种元素的单质中,Z的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。工业上“候氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
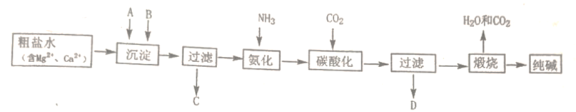
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A_____________,B_____________。
(2)碳酸化后过滤,滤液D最主要的成分是__________(填写化学式),检验这一成分的阴离子的具体方法是: ______。
(3)该工艺流程中可回收再利用的物质是_______。
(4)产品纯碱中含有碳酸氢钠,如果取m1 kg纯碱加热分解后剩余固体质量为m2 kg,纯碱中碳酸氢钠的质量分数可表示为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)某同学取10 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=__________(保留2位有效数字)。
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。需要准备的实验仪器有托盘天平、药匙、烧杯、胶头滴管、__________、__________。
(3)配制时,其正确的操作顺序是__________。
A 盖好瓶塞,反复上下颠倒,摇匀
B 根据计算结果,称量NaClO固体
C 将称好的NaClO固体放入烧杯中,用适量蒸馏水溶解
D 将烧杯中的溶液注入容量瓶,用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液均注入容量瓶,振荡
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F 继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
(4)下列操作使配制溶液浓度偏高的是________,使配制溶液浓度偏低的是_______,对配制溶液浓度无影响的是______(填序号)
①选用的容量瓶内有少量蒸馏水;
②定容时仰视容量瓶刻度线;
③定容时俯视容量瓶刻度线;
④烧杯中溶液倾倒完毕,忘记洗涤烧杯和玻璃棒;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个 ( )
①重水的化学式为T2O
②CO2的比例模型:![]()
③H2O2的电子式:![]()
④硅酸盐Ca2 Mg5 Si8 O22(OH)2可用氧化物形式表示为:2CaO﹒5MgO﹒8SiO2 ﹒H2O
⑤硅胶有吸水性,是常用的食品干燥剂
⑥医疗上常用乙醇体积分数为95%的酒精杀菌消
⑦聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
⑧水中的钢闸门连接电源的负极属于牺牲阳极的阴极保护法
⑨食盐可作调味剂,也可作食品防腐剂
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验与对应的图象符合的是( )
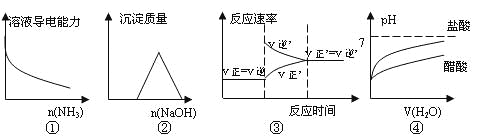
A.①是向一定量的CH3COOH溶液中通入氨气
B.②是向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量
C.③是对于达到平衡状态的![]() 反应,在t1时缩小容器,并在t2时又达到平衡。
反应,在t1时缩小容器,并在t2时又达到平衡。
D.④是将pH=2的盐酸和醋酸分别加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
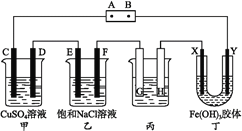
(1)电源A极的名称是____________。
(2)甲装置中电解反应的总化学方程式:______________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是____________。
(4)欲用丙装置给铜镀银,G应该是__________(填“铜”或“银”),电镀液的主要成分是___________(填化学式)。
(5)装置丁中的现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘的工业生产过程如下:
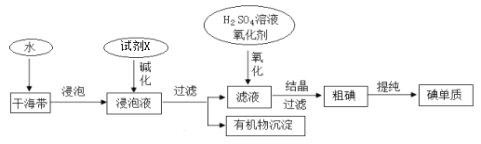
下列说法不正确的是 ( )
A.试剂X可以为NaOH溶液,其作用是使浸泡液中的可溶性有机物形成沉淀
B.氧化剂可以用H2O2或适量的Cl2
C.干海带浸泡液中的碘离子可用淀粉溶液检验
D.氧化后的滤液在实验室也可采用四氯化碳萃取、分液、蒸馏的方法得到粗碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________。
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
18K金成分 | Au | Ag |
含量(质量分数) | 75.00% | _________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com