
【题目】课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
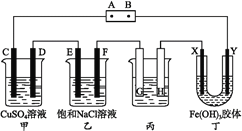
(1)电源A极的名称是____________。
(2)甲装置中电解反应的总化学方程式:______________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是____________。
(4)欲用丙装置给铜镀银,G应该是__________(填“铜”或“银”),电镀液的主要成分是___________(填化学式)。
(5)装置丁中的现象是_______________。
【答案】正极  1:1 银 AgNO3 Y极附近红褐色变深
1:1 银 AgNO3 Y极附近红褐色变深
【解析】
将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色,说明F电极为阴极,则E为阳极,所以C、G、X都是阳极,D、H、Y都是阴极,A为电源正极,B为电源负极。
(1)连接阴极的电极负极、连接阳极的电极是正极,A连接阳极,则为正极;
(2)甲中阳极上氢氧根离子放电、阴极上铜离子放电生成铜,所以电池反应式为 ;
;
(3)乙中阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,生成相同物质的量的氢气、氯气时转移电子相等,电解过程中转移电子总数相等,所以生成氢气、氯气物质的量相等,相同条件下气体的物质的量之比等于体积之比,所以氯气和氢气体积之比为1:1;
(4)欲用丙装置给铜镀银,Ag作阳极、Cu作阴极,则G为银,电解质为AgNO3;
(5)氢氧化铁胶粒带正电荷,通电时向阴极移动,Y为阴极,所以看到的现象是Y极附近红褐色变深。
【点晴】
正确判断阴阳极是解本题关键,将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色,说明F电极为阴极,则E为阳极,所以C、G、X都是阳极,D、H、Y都是阴极,难点是根据电子守恒进行有关计算,(5)的现象能说明氢氧化铁胶粒带正电荷,据此解题。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
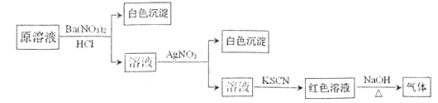
A.原溶液中一定含有![]() 离子B.原溶液中一定含有
离子B.原溶液中一定含有![]()
C.原溶液中一定含有Cl-离子D.原溶液中一定含有Fe3+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙醇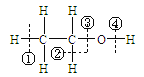 在化学反应中断键位置说法错误的是 ( )
在化学反应中断键位置说法错误的是 ( )
A. 乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应。
B. 乙醇与钠反应,在④位置断裂,对比钠与水反应,乙醇比水更难失去氢离子。
C. 乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应属于取代反应。
D. 乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质B的质量分数减小了
C.物质A的转化率减小了
D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,可以模拟铁的电化学腐蚀,下列说法不正确的是( )

A.若X为碳棒,为减慢铁的腐蚀,开关K应置于N处
B.若X为锌棒,K置于M或N处,均能减慢铁的腐蚀
C.若X为碳棒,将开关K置于M处时铁棒上发生的反应为Fe-2e-=Fe2+
D.若X为锌棒,将开关K置于N处时铁棒上发生的反应为Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→![]() +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
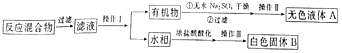
已知:苯甲酸相对分子质量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点。
(1)操作1为_________________,操作Ⅱ为“蒸馏”,需选用的玻璃仪器除了圆底烧瓶、蒸馏头、温度计、接收管(牛角管)之外,还有___________(填序号)
A.球形冷凝管 B.直形冷凝管 C.接收瓶 D.烧杯
(2)操作Ⅲ具体实验步骤依次为__________、抽滤。将物质放在布氏漏斗中打开抽气泵一段时间后布氏漏斗中剩余的是白色固体B,抽滤装置可以加快过滤速率其工作原理是_______
(3)测定白色固体B的熔点,发现其在115℃开始熔化达到130℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与少量KCl的混合物。
①欲从混合物中提纯苯甲酸应进行的操作是_______________________
②在①提纯过程中应对晶体进行洗涤除去晶体表面附着杂质,如何检验洗涤已经完全:_______
③欲检验经过①提纯后的固体是否纯净,可以采用的实验方法是______,如果固体纯净对应的现象是___________________________
(4)纯度测定:称取1.220g产品,配成100mL甲醇溶液移取25.00mL溶液滴定,消耗KOH的物质的量为2.40×10-3mol产品中苯甲酸质量分数为_________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
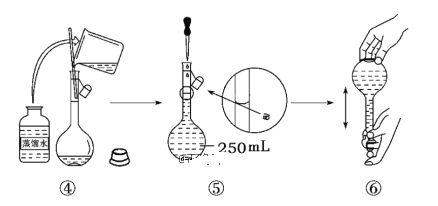
【题目】实验室需要0.2mol·L-1Na2CO3溶液250mL和0.5mol·L-1盐酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图是某同学用Na2CO3·10H2O配制0.2mol·L-1Na2CO3溶液250mL的过程,其中错误的步骤有___。(填实验操作序号)
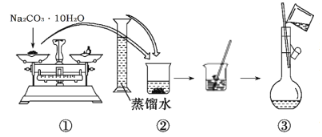
(2)根据计算,用托盘天平称取Na2CO3·10H2O的质量为__g。若定容时液面高于刻度线,应采取的措施是___。
(3)配制0.5mol·L-1盐酸溶液450mL 溶液需要玻璃仪器除烧杯、胶头滴管、量筒外还需要___。
(4)由计算知,该实验中配制0.5mol·L-1盐酸时需用量筒量取质量分数为36.5%、密度为1.2g/cm3的浓盐酸___mL。在实验中其它操作均正确,若定容时俯视刻度线,则所得盐酸溶液浓度___0.5mol·L-1(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.25℃时某溶液中水电离出的c(H+)=1.0×1012 mol·L1,其pH一定是12
B.某温度下,向氨水中通入CO2,随着CO2的通入,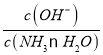 不断增大
不断增大
C.恒温恒容下,反应X(g)+3Y(g) ![]() 2Z(g),起始充入3 mol X和3 mol Y,当X的体积分数不变时,反应达到平衡
2Z(g),起始充入3 mol X和3 mol Y,当X的体积分数不变时,反应达到平衡
D.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,该温度下加入等体积pH=10的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com