
【题目】利用如图所示装置,可以模拟铁的电化学腐蚀,下列说法不正确的是( )

A.若X为碳棒,为减慢铁的腐蚀,开关K应置于N处
B.若X为锌棒,K置于M或N处,均能减慢铁的腐蚀
C.若X为碳棒,将开关K置于M处时铁棒上发生的反应为Fe-2e-=Fe2+
D.若X为锌棒,将开关K置于N处时铁棒上发生的反应为Fe-2e-=Fe2+
【答案】D
【解析】
根据金属的防护,若K置于N处,形成电解池,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,若要使金属铁被保护,需让铁做正极,据此分析判断。
A.若X为碳棒,当开关K置于N处时,形成电解池,铁做阴极被保护,能减缓铁的腐蚀,故A正确;
B.若X为锌棒,开关K置于M处,形成原电池,锌比铁活泼,锌为负极,铁做正极,在原电池中正极被保护,能减缓铁的腐蚀;当开关K置于N处时,形成电解池,铁做阴极被保护,能减缓铁的腐蚀,故B正确;
C.若X为碳棒,开关K置于M处,形成原电池,铁做负极,铁棒上发生的反应为Fe-2e-=Fe2+,故C正确;
D.当X为锌时,开关K置于N处,形成电解池,铁做阴极,故阴极上的电极反应为:O2+4e-+2H2O=4OH-,故D错误;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
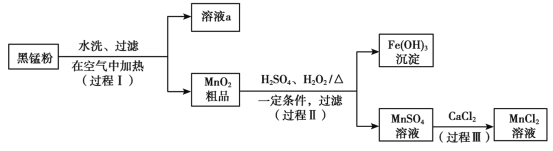
(1)过程Ⅰ中,在空气中充分加热黑锰粉的目的主要是除去__________和氧化锰元素,请写出含Mn元素的物质发生反应的化学方程式____________________________。
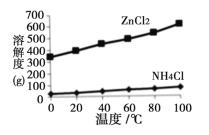
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。根据右图所示的溶解度曲线,将溶液a经___________、_______________、过滤可得NH4Cl粗品。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入____________(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①用化学方程式表示ⅱ中MnO2溶解的原因:__________________。
②解释试剂加入顺序不同,MnO2作用不同的原因:_______________________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某品牌饮用矿物质水标签的部分内容。下列说法正确的是

A. 标签上给出的离子的物理量是物质的量浓度
B. 任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之间
C. 该品牌饮用矿物质水中c(Mg2+)的最大值为2×10-4 mol/L
D. 一瓶该品牌饮用矿物质水中SO42-的物质的量不超过1×10-5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个 ( )
①重水的化学式为T2O
②CO2的比例模型:![]()
③H2O2的电子式:![]()
④硅酸盐Ca2 Mg5 Si8 O22(OH)2可用氧化物形式表示为:2CaO﹒5MgO﹒8SiO2 ﹒H2O
⑤硅胶有吸水性,是常用的食品干燥剂
⑥医疗上常用乙醇体积分数为95%的酒精杀菌消
⑦聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
⑧水中的钢闸门连接电源的负极属于牺牲阳极的阴极保护法
⑨食盐可作调味剂,也可作食品防腐剂
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍、工业上用ClO2气体制 NaClO2的工艺流程如下:
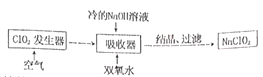
已知: NaClO2的溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。下列说法不正确的是( )
A.流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
B.提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
C.吸收器中生成的NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
D.发生器中反应结束后,向其中通入空气的目的是驱赶出ClO2,使其被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
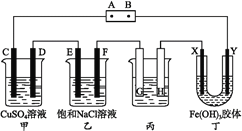
(1)电源A极的名称是____________。
(2)甲装置中电解反应的总化学方程式:______________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是____________。
(4)欲用丙装置给铜镀银,G应该是__________(填“铜”或“银”),电镀液的主要成分是___________(填化学式)。
(5)装置丁中的现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计城市机动车辆每年以15%至20%的速度增长,交通事故也频发,汽车在剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。则下列判断正确的是
A. 还原剂与氧化产物的物质的量之比为5:8
B. 若氧化产物比还原产物多1.4mol则转移电子为1mol
C. 每生成1.6mol氮气,则有0.2molKNO3被氧化
D. NaN3是只含有离子键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C6H6O)是一种重要的化工原料,广泛用于制造树脂、医药等。
Ⅰ.以A、B为原料合成扁桃酸衍生F的路线如下。

(1)A的名称是____;B的结构简式是____。
(2)C(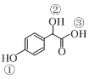 )中①~③羟基氢原子的活性由强到弱的顺序是____。
)中①~③羟基氢原子的活性由强到弱的顺序是____。
(3)D的结构简式是____。
(4)写出F与过量NaOH溶液反应的化学方程式:___________。
(5)若E分子中含有3个六元环,则E的结构简式是________。
Ⅱ.以A为原料合成重要的医药中间体K的路线如下。
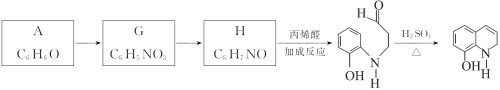
(6)G→H的反应类型是__________。
(7)一定条件下,K与G反应生成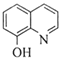 、H和水,化学方程式是__________。
、H和水,化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是( )

A.实验I中溶液红色褪去,说明发生了反应H++OH-![]() H2O
H2O
B.实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中仍然存在大量的Na+与OH
C.实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应2H++SO42-+Ba2++2OH-= 2H2O+BaSO4↓
D.将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com