
【题目】苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→![]() +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
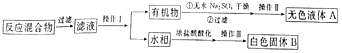
已知:苯甲酸相对分子质量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点。
(1)操作1为_________________,操作Ⅱ为“蒸馏”,需选用的玻璃仪器除了圆底烧瓶、蒸馏头、温度计、接收管(牛角管)之外,还有___________(填序号)
A.球形冷凝管 B.直形冷凝管 C.接收瓶 D.烧杯
(2)操作Ⅲ具体实验步骤依次为__________、抽滤。将物质放在布氏漏斗中打开抽气泵一段时间后布氏漏斗中剩余的是白色固体B,抽滤装置可以加快过滤速率其工作原理是_______
(3)测定白色固体B的熔点,发现其在115℃开始熔化达到130℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与少量KCl的混合物。
①欲从混合物中提纯苯甲酸应进行的操作是_______________________
②在①提纯过程中应对晶体进行洗涤除去晶体表面附着杂质,如何检验洗涤已经完全:_______
③欲检验经过①提纯后的固体是否纯净,可以采用的实验方法是______,如果固体纯净对应的现象是___________________________
(4)纯度测定:称取1.220g产品,配成100mL甲醇溶液移取25.00mL溶液滴定,消耗KOH的物质的量为2.40×10-3mol产品中苯甲酸质量分数为_________(保留两位有效数字)。
【答案】分液 BC 蒸发浓缩、冷却结晶 抽出装置中的空气,形成压强差,使过滤加快 重结晶 取最后一次洗涤液,加入硝酸酸化的硝酸银溶液,没有白色沉淀生成,说明洗涤完全 测定固体熔点 白色晶体在122.4℃左右完全熔化 96%
【解析】
(1)根据分离不互溶的液体混合物采用分液的方法分析,根据蒸馏实验中需要进行加热和冷却和接收分析使用的仪器。
(2)根据苯甲酸的溶解度随温度的变化分析分离的操作。
(3)根据固体可能吸附氯离子,氯离子能与硝酸银反应生成白色氯化银沉淀进行分析。
(4)根据纯净物有固定的熔点分析检验方法。
(5)根据苯甲酸为一元酸,与氢氧化钾反应比例为1:1进行计算苯甲酸的质量分数。
(1)操作Ⅰ为分离有机物和水,属于分离分层的液体混合物,为分液操作,操作Ⅱ为“蒸馏”,需圆底烧瓶、蒸馏头、温度计、接收管(牛角管)和直形冷凝管和接收瓶,故选BC;
(2)苯甲酸相对分子质量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g,因为分离苯甲酸用重结晶的方法,操作为蒸发浓缩、冷却结晶;抽滤过程中抽出装置中的空气,形成压强差,使过滤加快;
(3)①因为苯甲酸在不同温度下的溶解度差异较大,所以用重结晶的方法分离;
②固体表面可能吸附氯离子,所以取最后一次洗涤液,加入硝酸酸化的硝酸银溶液,没有白色沉淀生成,说明没有氯离子,洗涤完全;
③纯净固体有机物一般都有固定熔点,所以可以测定固体熔点;若白色晶体在122.4℃左右完全熔化,说明固体为纯的苯甲酸。
(4)苯甲酸是一元弱酸和氢氧化钾按1:1反应,所以苯甲酸的质量分数为![]() =96%。
=96%。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】将1 mol N2和 3 mol H2充入体积可变的恒温密闭容器中,在380 ℃下发生反应:N2(g)+3H2(g)![]() 2NH3(g),平衡时,体系中氨的体积分数
2NH3(g),平衡时,体系中氨的体积分数![]() (NH3)随压强变化的情况如下表:
(NH3)随压强变化的情况如下表:
压强/MPa | 10 | 20 | 30 | 40 |
| 0.30 | 0.45 | 0.54 | 0.60 |
下列说法正确的是( )
A.10 MPa时,H2的转化率为75%
B.20 MPa时,NH3的物质的量浓度是10 MPa时的1.5倍
C.40 MPa时,若容器的体积为V L,则平衡常数K=![]()
D.30 MPa时,若向容器中充入惰性气体,则平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个 ( )
①重水的化学式为T2O
②CO2的比例模型:![]()
③H2O2的电子式:![]()
④硅酸盐Ca2 Mg5 Si8 O22(OH)2可用氧化物形式表示为:2CaO﹒5MgO﹒8SiO2 ﹒H2O
⑤硅胶有吸水性,是常用的食品干燥剂
⑥医疗上常用乙醇体积分数为95%的酒精杀菌消
⑦聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
⑧水中的钢闸门连接电源的负极属于牺牲阳极的阴极保护法
⑨食盐可作调味剂,也可作食品防腐剂
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
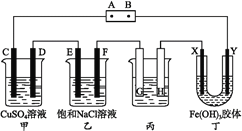
(1)电源A极的名称是____________。
(2)甲装置中电解反应的总化学方程式:______________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是____________。
(4)欲用丙装置给铜镀银,G应该是__________(填“铜”或“银”),电镀液的主要成分是___________(填化学式)。
(5)装置丁中的现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计城市机动车辆每年以15%至20%的速度增长,交通事故也频发,汽车在剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。则下列判断正确的是
A. 还原剂与氧化产物的物质的量之比为5:8
B. 若氧化产物比还原产物多1.4mol则转移电子为1mol
C. 每生成1.6mol氮气,则有0.2molKNO3被氧化
D. NaN3是只含有离子键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘的工业生产过程如下:
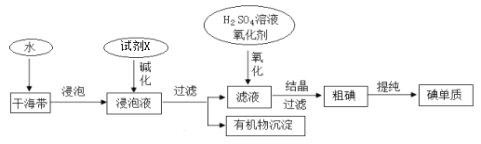
下列说法不正确的是 ( )
A.试剂X可以为NaOH溶液,其作用是使浸泡液中的可溶性有机物形成沉淀
B.氧化剂可以用H2O2或适量的Cl2
C.干海带浸泡液中的碘离子可用淀粉溶液检验
D.氧化后的滤液在实验室也可采用四氯化碳萃取、分液、蒸馏的方法得到粗碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C6H6O)是一种重要的化工原料,广泛用于制造树脂、医药等。
Ⅰ.以A、B为原料合成扁桃酸衍生F的路线如下。

(1)A的名称是____;B的结构简式是____。
(2)C(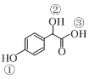 )中①~③羟基氢原子的活性由强到弱的顺序是____。
)中①~③羟基氢原子的活性由强到弱的顺序是____。
(3)D的结构简式是____。
(4)写出F与过量NaOH溶液反应的化学方程式:___________。
(5)若E分子中含有3个六元环,则E的结构简式是________。
Ⅱ.以A为原料合成重要的医药中间体K的路线如下。
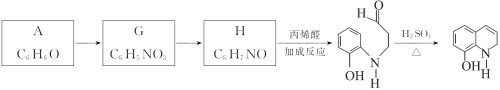
(6)G→H的反应类型是__________。
(7)一定条件下,K与G反应生成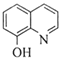 、H和水,化学方程式是__________。
、H和水,化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。利用常用的酸、碱和工业生产中的废铁屑,设计如下工艺流程,从废水中回收金,并生产一定量的铁红和氧化铜。
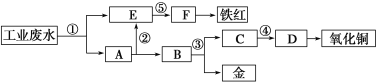
下列说法不正确的是( )
A.标号①②③处发生的反应均为氧化还原反应
B.标号③处加入的相应物质是稀硝酸或稀硫酸
C.标号①处发生的离子反应最多有三个
D.铁红的化学式为Fe2O3,工业上常用作红色颜料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出(溶液体积变化忽略不计),所得溶液Q中的![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 溶液Q比原溶液增重了1.92g.
B. Q中n(Cu2+):n(Fe3+)=3:4
C. 反应中转移的电子数为0.04mol
D. n(Cu2+)=0.03mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com