
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
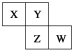
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性Z比W强
C. Y的气态氢化物的稳定性较Z的弱
D. 四种元素的单质中,Z的熔、沸点最高
【答案】D
【解析】
X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子只能有2个电子层,最外层电子数为6,所以Y为氧元素;根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素,据此分析解答。
根据上述分析,X为氮元素,Y为氧元素,Z为硫元素,W为氯元素。
A.一般而言,电子层越多,半径越大,电子层数相同,核电荷数越大,半径越小,故原子半径Z>W>X>Y,故A错误;
B.非金属性W>Z,故最高价氧化物对应水化物的酸性W>Z,故B错误;
C.非金属性Y>Z,故Y的气态氢化物的稳定性较Z的强,故C错误;
D.四元素的单质中,硫常温下为固体,其它三种为气体,故硫的熔、沸点最高,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】一端封闭的U形管,封闭的一端有一段CH4和Cl2的混合气体,在水平部分有一段气柱,其他两段为液柱,已知液体与气体不反应.使CH4和Cl2在稍暗的光线下缓慢反应,则中间气柱的长度将(假设中间气柱未移出U形管水平部分)( )

A. 变大B. 变小C. 不变D. 难以确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如下图所示。

该方案的实验原理是自发进行的氧化还原反应可以设计为原电池。写出该氧化还原反应的离子方程式:__________。该装置中的负极材料是______(填化学式),正极反应式是_______。
(2)某研究性学习小组为证明2Fe3++2I-2Fe2++I2为可逆反应,设计如下两种方案。
方案一:
取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,再继续加入2mLCCl4,充分振荡、静置、分层,再取上层清液,滴加KSCN溶液。
①方案一中能证明该反应为可逆反应的现象是______。
②有同学认为方案一设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是(用离子方程式表示)_____。
方案二:
设计如下图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右管中加入1mol/L FeCl2溶液。

③方案二中,“读数变为零”是因为____________.
④“在右管中加入1mol/L FeCl2溶液”后,观察到灵敏电流计的指针______偏转(填“向左”、“向右”或“不”),可证明该反应为可逆反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,都是强电解质的是( )
A.HNO3、HCl、BaSO4B.NH4Cl、CH3COOH、Na2S
C.NaOH、Ca(OH)2、NH3·H2OD.HClO、CH3COONa、Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A. FeBr2溶液中加入等物质的量的Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3++Br2+4Cl-
B. 用氢氟酸在玻璃上“刻字”:SiO2 + 4H+ + 4F- = SiF4↑+ 2H2O
C. 将铜丝投入稀硝酸中:Cu + 4H+ + 2NO3-= Cu2+ + 2NO2↑+ 2H2O
D. NaOH与NH4Cl溶液混合加热:NH4+ + OH- ![]() NH3·H2O
NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
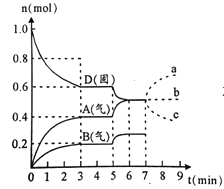
A. 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.0667 mol/(L·min)
B. 该反应的化学方程式为2D(s) 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B)
C. 已知:反应的H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸.请根据以上信息回答下列问题.
(1)C元素在元素周期表中的位置是________________
(2)画出B元素的离子结构示意图______________
(3)与E的氢化物分子所含电子总数相等的分子是_____(举一例,填化学式,下同)、离子是_________
(4)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为_________
(5)写出A元素与B元素形成化合物的化学式________
(6)下列可以判断C和D非金属性强弱的是_______
a.单质的熔点C比D低 b.单质与氢气反应C比D剧烈
c.气态氢化物稳定性C比D稳定 d.单质的密度C比D小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠广泛地应用于生产、实验和日常生活中。某课外小组同学通过查阅资料对碳酸氢钠的性质和制法进行了系列实验,请你参与探究。
(1)向NaHCO3溶液滴加MnCl2溶液生成沉淀MnCO3,离子方程式为______。
(2)向NaHCO3溶液加入少量的镁粉,观察到有气体和白色沉淀生成,则该气体一定是______(填化学式),白色沉淀可能是:①MgCO3;②Mg(OH)2;③Mg2(OH)2CO3。欲证明白色沉淀为②,简单的实验方法为______(操作、现象和结论)。
(3)电解Na2CO3溶液制NaHCO3的原理如图—1所示.
①电解初期,电解池中总反应方程式为______。
②若电解过程中透过交换膜的Na+为 0.4 mol,则阳极收集到 O2_____L(标况)。
③电解后期溶液中的含碳微粒逐渐减少,此阶段阳极反应式为______。
(4) “侯氏制碱法”的原理是: NaCl+NH3+ CO2+H2O= NaHCO3+NH4Cl,模拟该制法的部分装置如图—2所示.
① 正确的操作是______(填序号)。
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b通入NH3,然后a通入CO2,c中放碱石灰
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
② 水槽中的冷水起降温作用,这样有利于______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH4+、SO42-、CO32-、K+ B. Na+、Ba2+、Ca2+、HCO3-
C. Mg2+、SO42-、K+、Cl- D. K+、Cl-、Na+、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com