
【题目】(1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如下图所示。

该方案的实验原理是自发进行的氧化还原反应可以设计为原电池。写出该氧化还原反应的离子方程式:__________。该装置中的负极材料是______(填化学式),正极反应式是_______。
(2)某研究性学习小组为证明2Fe3++2I-2Fe2++I2为可逆反应,设计如下两种方案。
方案一:
取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,再继续加入2mLCCl4,充分振荡、静置、分层,再取上层清液,滴加KSCN溶液。
①方案一中能证明该反应为可逆反应的现象是______。
②有同学认为方案一设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是(用离子方程式表示)_____。
方案二:
设计如下图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右管中加入1mol/L FeCl2溶液。

③方案二中,“读数变为零”是因为____________.
④“在右管中加入1mol/L FeCl2溶液”后,观察到灵敏电流计的指针______偏转(填“向左”、“向右”或“不”),可证明该反应为可逆反应。
【答案】Cu+2Fe3+=Cu2++2Fe2+ Cu Fe3+ + e- = Fe2+ 下层(CCl4层)溶液呈紫红色,且上层清液中滴加KSCN后溶液呈血红色 4Fe2++O2+4H+=2H2O+4Fe3+ 该可逆反应达到了化学平衡状态 向左
【解析】
(1)验证Fe3+与Cu2+氧化性强弱时,应将反应Cu+2Fe3+=Cu2++2Fe2+设计成原电池,原电池中铜作负极发生氧化反应被损耗,选用金属性弱于铜的金属或非金属C作正极,电解质溶液为可溶性的铁盐;
(2)方案一:如该反应为可逆反应,加入四氯化碳,四氯化碳层呈紫红色,上层清液中滴加KSCN后溶液呈血红色;但在振荡过程中,Fe2+离子易被空气中氧气生成Fe3+,不能证明Fe3+未完全反应;
方案二:图中灵敏电流计的指针指向右,右侧烧杯为正极,当指针读数变零后,在右管中加入1mol/LFeCl2溶液,如为可逆反应,可发生2Fe2++I22Fe3++2I-,I2被还原,指针应偏向左。
(1)Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+反应,反应中Cu被氧化,Cu电极为原电池的负极,负极反应式为Cu-2e-=Cu2+,选用金属性弱于铜的金属或石墨作正极,正极上Fe3+发生还原反应,电极反应式为Fe3++e-=Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+;Cu; Fe3+ + e- = Fe2+;
(2)①若该反应为可逆反应,反应中有碘单质生成,但不足量的Fe3+不能完全反应,溶液中依然存在Fe3+,则证明有碘单质和Fe3+存在的实验设计为:向反应后的溶液再继续加入2mLCCl4,充分振荡、静置、分层,下层(CCl4层)溶液呈紫红色,再取上层清液,滴加KSCN溶液,溶液呈血红色,故答案为:下层(CCl4层)溶液呈紫红色,且上层清液中滴加KSCN后溶液呈血红色;
②在振荡过程中,Fe2+离子易被空气中氧气生成Fe3+,不能证明反应可逆,反应的化学方程式为4Fe2++O2+4H+=2H2O+4Fe3+,故答案为:4Fe2++O2+4H+=2H2O+4Fe3+;
③若该反应为可逆反应,“读数变为零”说明该可逆反应达到了化学平衡状态,故答案为:该可逆反应达到了化学平衡状态;
④当指针读数变零后,在右管中加入1mol/LFeCl2溶液,如为可逆反应,可发生2Fe2++I22Fe3++2I-,I2被还原,灵敏电流计指针总是偏向电源正极,指针应偏向左,故答案为:向左。


科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)氮化钙是一种棕色粉末,在空气中氧化,遇水会发生水解,生成氢氧化钙并放出氨。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
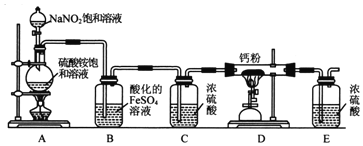
Ⅰ.氮化钙的制备
(1)连接装置后,检查整套装置气密性的方法是_____________________。
(2)装置A中每生成标准状况下4.48LN2,转移的电子数为___________________。
(3)装置B的作用是吸收氧气,则B中发生反应的离子方程式为__________。装置E的作用是______________________。
(4)实验步骤如下:检查装置气密性后,装入药品;_____________________(请按正确的顺序填入下列步骤的代号)。
①加热D处的酒精喷灯; ②打开分液漏斗活塞; ③加热A处的酒精灯;④停上加热A处的酒精灯;⑤停止加热D处的酒精喷灯
(5)请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象___________。
Ⅱ.测定氮化钙的纯度:
①称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL1.00mol·L-1盐酸中,充分反应后,将所得溶液稀释至200.00mL;
②取20.00mL稀释后的溶液,用0.20mol·L-1NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗标准溶液25.00mL。
(1)氮化钙的质量分数为_________。
(2)达到滴定终点时,仰视滴定管读数将使测定结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关合金的叙述中正确的是( )
A.合金的密度比各成分金属小
B.合金的抗腐蚀性能都很好
C.合金的导电性比各成分金属强
D.合金的种类和性能与成分有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机物X、Y、Z、M的相互转化关系如图所示(部分反应条件、部分反应中的H.,O已略去)。X、Y、Z均含有同一种元素。下列说法正确的是

A. 若X是氢氧化钠,则M不一定为CO2
B. 若Y具有两性,则M的溶液只可能显碱性
C. 若Z是导致酸雨的主要气体,则X一定是H2S
D. 若M是用途最广的金属,加热蒸干Y的溶液一定能得到Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)随原子序数的递增,八种短周期元素x、y、z、d、e、f、g、h原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题:

① 比较y、z、d的气态氢化物的稳定性强弱是:_______>________>________(用化学式表示)
② 由表中两种元素的原子按1:1组成的化合物A,A中既含离子键又含非极性共价键,其电子式为_____;
③ 下列四种元素的原子序数如下,其中不是和f同一主族的是____________
a.5 b. 21 c. 49 d. 81
④能表示出g和h元素非金属性强弱的离子方程式是______________;能表示出y和h最高价氧化物的水化物的酸性强弱的离子方程式是______________。
(2)F、Cl、Br、I位于周期表的VIIA族。通过下列实验比较出卤族氧化性的强弱。实验如下:

①通过卤素间置换反应比较氧化性强弱的实验是___________。(填写1、2、3、4)
②滴加CCl4的目的是_________________。
③上述实验能否说明氯的氧化性强于溴?判断并说明你的依据__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列药品保存方法,正确的是 ( )
A. 乙醇密封保存,放置于阴凉处
B. 氢氧化钠溶液用橡胶塞密封保存在细口瓶中
C. 浓硫酸保存在广口瓶中,没有挥发性,无须密封
D. 金属钠和钾等很活泼的金属可以保存在煤油或石蜡中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是

A. a棉球褪色,验证SO2具有氧化性
B. b棉球褪色,验证SO2具有酸性氧化物的通性
C. c棉球蓝色褪去,验证SO2漂白性
D. 可以使用浓硫酸吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
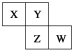
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性Z比W强
C. Y的气态氢化物的稳定性较Z的弱
D. 四种元素的单质中,Z的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化的主要原理为:2NO+2CO![]() N2+2CO2 ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。能判断该反应达到平衡状态的标志是
N2+2CO2 ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。能判断该反应达到平衡状态的标志是
A. 在单位时间内生成1mol CO2的同时消耗了lmol CO
B. 混合气体的密度不再改变
C. 混合气体的平均相对分子质量不再改变
D. 相同时间内,形成CO2分子内键的数目是断开N2分子内键的数目的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com