
【题目】氮化钙(Ca3N2)氮化钙是一种棕色粉末,在空气中氧化,遇水会发生水解,生成氢氧化钙并放出氨。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
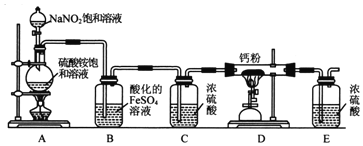
Ⅰ.氮化钙的制备
(1)连接装置后,检查整套装置气密性的方法是_____________________。
(2)装置A中每生成标准状况下4.48LN2,转移的电子数为___________________。
(3)装置B的作用是吸收氧气,则B中发生反应的离子方程式为__________。装置E的作用是______________________。
(4)实验步骤如下:检查装置气密性后,装入药品;_____________________(请按正确的顺序填入下列步骤的代号)。
①加热D处的酒精喷灯; ②打开分液漏斗活塞; ③加热A处的酒精灯;④停上加热A处的酒精灯;⑤停止加热D处的酒精喷灯
(5)请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象___________。
Ⅱ.测定氮化钙的纯度:
①称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL1.00mol·L-1盐酸中,充分反应后,将所得溶液稀释至200.00mL;
②取20.00mL稀释后的溶液,用0.20mol·L-1NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗标准溶液25.00mL。
(1)氮化钙的质量分数为_________。
(2)达到滴定终点时,仰视滴定管读数将使测定结果_________(填“偏高”、“偏低”或“无影响”)。
【答案】关闭A,向E中加水,微热烧瓶E中有气泡停止加热导管末端形成一段水柱0.6NA4Fe2++O2+4H+=4Fe3++2H2O吸收空气中水蒸气、防止进入D中②③①⑤④取少量产物于试管,加入水,用排水法收集到无色气体则含钙92.5%偏低
【解析】
本题考查的是物质的制备和含量测定,弄清实验装置的作用、发生的反应及指标原理是关键,侧重分析与实验能力的考查,注意物质性质的综合应用。
装置A中反应生成氮气,装置B可以吸收氧气,C中浓硫酸吸水,氮气和钙粉在装置D中反应,E中浓硫酸防止空气中的水蒸气进入D。(1)连接装置后,关闭A中分液漏斗的活塞,向E中加水,微热烧瓶,E中有气泡停止加热导管末端形成一段水柱,说明装置气密性好。(2)A中的反应为(NH4)2SO4+2NaNO2 ![]() 2N2↑+Na2SO4+4H2O,转移6mol电子时生成2mol氮气,所以A中每生成标况下4.48L氮气,转移的电子数为0.6NA。(3)B中氧气氧化亚铁离子为铁离子,离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,E装置中浓硫酸吸收空气中的水蒸气,防止进入D中。 (4)实验开始先使装置的反应发生,排除装置内的空气,实验结束,先停止D处的热源,故顺序为②③①⑤④。(5)氮化钙与水反应生成氨气,钙与水反应生成氢气,氢气难溶于水,氨气极易溶于水,检验生成的气体有氢气即可确定氮化钙中含有为反应的钙,故方法为:取少量产物于试管,加入水,用排水法收集到无色气体则含钙 Ⅱ.(1)剩余的盐酸物质的量为
2N2↑+Na2SO4+4H2O,转移6mol电子时生成2mol氮气,所以A中每生成标况下4.48L氮气,转移的电子数为0.6NA。(3)B中氧气氧化亚铁离子为铁离子,离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,E装置中浓硫酸吸收空气中的水蒸气,防止进入D中。 (4)实验开始先使装置的反应发生,排除装置内的空气,实验结束,先停止D处的热源,故顺序为②③①⑤④。(5)氮化钙与水反应生成氨气,钙与水反应生成氢气,氢气难溶于水,氨气极易溶于水,检验生成的气体有氢气即可确定氮化钙中含有为反应的钙,故方法为:取少量产物于试管,加入水,用排水法收集到无色气体则含钙 Ⅱ.(1)剩余的盐酸物质的量为![]() ,故参与反应的盐酸为0.1×1-0.05=0.05mol,根据氮元素守恒:,则氮化钙的物质的量为0.025mol,则氮化钙的质量分数为
,故参与反应的盐酸为0.1×1-0.05=0.05mol,根据氮元素守恒:,则氮化钙的物质的量为0.025mol,则氮化钙的质量分数为![]() = 92.5% (2)达到滴定终点,仰视滴定管读数将使消耗的氢氧化钠的标准液的体积读数变大,使剩余盐酸的量变大,反应盐酸的的氨气的量变小,故测定结果偏小。
= 92.5% (2)达到滴定终点,仰视滴定管读数将使消耗的氢氧化钠的标准液的体积读数变大,使剩余盐酸的量变大,反应盐酸的的氨气的量变小,故测定结果偏小。


科目:高中化学 来源: 题型:
【题目】新制氢氧化铜存在平衡:Cu(OH)2 +2OH-![]() Cu(OH)42-(深蓝色)。某同学进行下列实验:
Cu(OH)42-(深蓝色)。某同学进行下列实验:
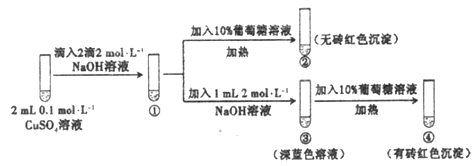
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2+ 2OH-![]() Cu(OH)42-正向移动的结果
Cu(OH)42-正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法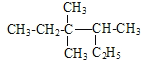 的名称为3,3-二甲基-2-乙基戊烷
的名称为3,3-二甲基-2-乙基戊烷
B. 分子式为C5H12O的醇共有8 种,其中能催化氧化成醛的同分异构体有3 种
C. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
D. 乙烯和苯均能使溴水因发生化学反应褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是

A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在一定体积pH = 12的NaOH溶液中, 加入一定体积0.01 mol/L的NaHSO4溶液,此时混合溶液的pH = 11。若反应后溶液的体积等于NaOH 溶液与NaHSO4溶液的体积之和,则NaOH溶液与NaHSO4溶液的体积比是( )
A. 1∶9 B. 10∶1 C. 11∶9 D. 1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能较好说明乙醇分子结构简式为C2H5OH,而不是CH3OCH3的事实是( )
A. 1mol乙醇完全燃烧只生成2molCO2和3molH2O
B. 乙醇无同分异构体
C. 0.1mol乙醇与足量钠反应只产生0.05mol氢气
D. 乙醇与水以任意比例互溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列要求填写以下空格:
(1)-COOH的名称是 ________________,
(2)-CHO的名称是___________________
(3)写出羟基的化学式_______________________
(4)苯的结构简式是_______________
(5)写出乙酸与碳酸钠反应的化学方程式______________________________________________ ,
该反应说明,乙酸的酸性____(填强或弱)于碳酸 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+ O2 (g)![]() 2SO3(g),其正反应放热。现有三个体积相同的密闭容器
2SO3(g),其正反应放热。现有三个体积相同的密闭容器
I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A. 容器I、III中平衡常数相同
B. 容器II、III中正反应速率相同
C. 容器II、III中的反应达平衡时, SO3的体积分数:II > III
D. 容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 含有金属元素的离子—定是阳离子
B. 含有离子键和共价键的化合物一定是离子化合物
C. 目前使用的元素周期表中,最长的周期含有36种元素
D. 第ⅦA族元素的阴离子还原性越强,其最高价氧化物的水化物的酸性越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com