
【题目】下列说法正确的是( )
A. 按系统命名法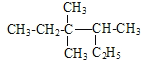 的名称为3,3-二甲基-2-乙基戊烷
的名称为3,3-二甲基-2-乙基戊烷
B. 分子式为C5H12O的醇共有8 种,其中能催化氧化成醛的同分异构体有3 种
C. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
D. 乙烯和苯均能使溴水因发生化学反应褪色
【答案】C
【解析】
A.烷烃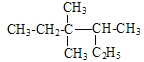 主链有6个碳原子,名称为:3,3,4-三甲基己烷,A错误;
主链有6个碳原子,名称为:3,3,4-三甲基己烷,A错误;
B.分子式为C5H12O,能被催化氧化成醛,则醇中连接羟基的碳原子上含有2个氢原子,当烷烃为CH3CH2CH2CH2CH3时,-OH取代甲基上的H原子有1种结构;当烷烃为(CH3)2CHCH2CH3时,-OH取代甲基上的H原子有2种结构;当烷烃为(CH3)4C时,-OH取代甲基上的H原子有1种结构,因此C5H12O的同分异构体中可以氧化为醛的醇有4种,B错误;
C.乙酸,氨基乙酸,蛋白质均含有羧基,所以都能与氢氧化钠反应,C正确;
D.苯与溴水发生的是萃取,不能发生化学反应,苯与液溴在催化剂作用下可以发生取代反应,D错误;
答案选C。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】(题文)有机物M的合成路线如下图:

已知:i: ii:
ii: 
(1)M中含氧官能团的名称有醚键和___________,C的名称为___________,步骤⑥的反应类型为___________。
(2)步骤④反应的化学方程式为_________________________________。
(3)试剂X的结构简式为___________。
(4)同时满足下列条件,E的同分异构体有__________种。
I.能与FeCl3溶液发生显色反应;II.能发生水解反应和银镜反应;III.苯环上只有两个取代基。
其中核磁共振氢谱峰面积比为1:1:2:2:6的分子的结构简式为: ______________________。
(5)根据以上信息,写出以![]() 为原料制取
为原料制取 的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2
的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A. 硅是非金属元素,它的单质是灰黑色有金属光泽的固体
B. 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C. 硅的化学性质不活泼,常温下不与任何物质反应
D. 粗硅的冶炼反应,体现了高温下SiO2的弱氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关气体摩尔体积的说法,正确的是( )
A.64gSO2的体积约为22.4L
B.1molO2的体积约为22.4L,则一定处于标准状况
C.在标准状况下,1molH2O的体积约为22.4L
D.总质量为28g的N2和CO的混合气体,在标准状况下的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)氮化钙是一种棕色粉末,在空气中氧化,遇水会发生水解,生成氢氧化钙并放出氨。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
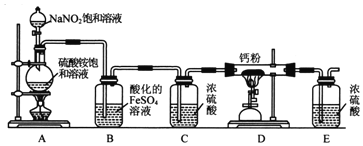
Ⅰ.氮化钙的制备
(1)连接装置后,检查整套装置气密性的方法是_____________________。
(2)装置A中每生成标准状况下4.48LN2,转移的电子数为___________________。
(3)装置B的作用是吸收氧气,则B中发生反应的离子方程式为__________。装置E的作用是______________________。
(4)实验步骤如下:检查装置气密性后,装入药品;_____________________(请按正确的顺序填入下列步骤的代号)。
①加热D处的酒精喷灯; ②打开分液漏斗活塞; ③加热A处的酒精灯;④停上加热A处的酒精灯;⑤停止加热D处的酒精喷灯
(5)请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象___________。
Ⅱ.测定氮化钙的纯度:
①称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL1.00mol·L-1盐酸中,充分反应后,将所得溶液稀释至200.00mL;
②取20.00mL稀释后的溶液,用0.20mol·L-1NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗标准溶液25.00mL。
(1)氮化钙的质量分数为_________。
(2)达到滴定终点时,仰视滴定管读数将使测定结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________________________。
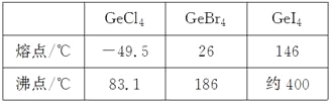
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为________。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com