
����Ŀ���������ӷ���ʽ����ȷ����
A. FeBr2��Һ�м�������ʵ�����Cl2��2Fe2+ + 2Br�� + 2Cl2 = 2Fe3++Br2+4Cl��
B. ��������ڲ���������������SiO2 + 4H+ + 4F�� = SiF4��+ 2H2O
C. ��ͭ˿Ͷ��ϡ�����У�Cu + 4H+ + 2NO3���� Cu2+ + 2NO2��+ 2H2O
D. NaOH��NH4Cl��Һ��ϼ��ȣ�NH4+ + OH�� ![]() NH3��H2O
NH3��H2O
���𰸡�A
��������A��FeBr2��Һ�м�������ʵ�����Cl2��Ӧ�����Ȼ������壻B��HF����������C��ϡ���ᱻ��ԭ��Ӧ��ԭ����ΪNO��D���������ƺ��Ȼ����Һ��ϼ������ɰ������ݴ˷����жϡ�
A��FeBr2��Һ�м�������ʵ�����Cl2��Ӧ�����Ȼ������壬���ӷ���ʽΪ2Fe2+ + 2Br�� + 2Cl2 = 2Fe3++Br2+4Cl������A��ȷ��B�������������ʴ���������ӷ�ӦΪSiO2+4HF�TSiF4��+2H2O����B����C����ͭ˿Ͷ��ϡ�����У����ӷ���ʽΪ��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O����C����D���������ƺ��Ȼ����Һ��ϼ������ɰ��������ӷ���ʽΪNH4++OH- ![]() NH3��+H2O����D����ѡA��
NH3��+H2O����D����ѡA��
���磺���⿼�������ӷ���ʽ�������жϡ�ע�����ӷ���ʽ�����жϳ��÷�������鷴Ӧ�ܷ�������鷴Ӧ��������Ƿ���ȷ���������ʲ���Ƿ���ȷ������Ƿ�����غ��ϵ�ȡ�������״���ΪA��Ҫע�����ʵ�����Ĺ�ϵ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������׳ơ������������������մ���Һ���������Ժͽ�ǿ�Ļ�ԭ�ԣ�����֯��Ư������ȼ������������еĻ�ԭ������������ƣ�Na2S2O3�������������ƺ����ͨ�����Ϸ�Ӧ�Ƶã�װ����ͼa��ʾ��

��֪��Na2S2O3��������Һ�в����ȶ����ڣ��й����ʵ��ܽ��������ͼb��ʾ��
��1��Na2S2O3��5H2O���Ʊ���
����1����ͼ���Ӻ�װ�ú��A��Cװ�������ԵIJ�����____________________��
����2������ҩƷ����K1���ر�K2�����ȡ�װ��B��D�е�ҩƷ��ѡ�����������е�_________�������ţ�
A��NaOH��Һ B��ŨH2SO4 C������KMnO4��Һ D������NaHCO3��Һ
����3��C�л��Һ��������������Ӧһ��ʱ�����۵������١���C����Һ��pH��7��10ʱ����K2���ر�K1��ֹͣ���ȣ�C����ҺҪ����pH��ԭ����____________��
����4������C�еĻ��Һ������Һ��������Ũ�������ȹ��ˣ��ٽ���Һ__________�����ˡ�________����ɣ��õ���Ʒ��
��2��Na2S2O3���ʵļ��飺
��������������ˮ�еμ�����Na2S2O3��Һ����ˮ��ɫ��dz�����鷴Ӧ����Һ�к����������д���÷�Ӧ�Ļ�ѧ����ʽ____________________________________________��
��3������Na2S2O3��Һ�ⶨ��ˮ��Ba2+Ũ�ȣ��������£�ȡ��ˮ25.00 mL�������ʵ�����ȼ�������K2Cr2O7��Һ����BaCrO4���������ˡ�ϴ�Ӻ�������ϡ�����ܽ⣮��ʱCrO42-ȫ��ת��ΪCr2O72-���ټӹ���KI��Һ����ַ�Ӧ���������Һ��ָʾ������0.010 mol��L-1��Na2S2O3��Һ���еζ�����Ӧ��ȫʱ������Na2S2O3��Һ18.00 mL�����ַ�Ӧ�����ӷ���ʽΪ��Cr2O72-+6I-+14H+=3I2+2Cr3++3I2+7H2O I2+2S2O32-=S4O62-+2I-����÷�ˮ��Ba2+�����ʵ���Ũ��Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ԭ�������ĵ��������ֶ�����Ԫ��x��y��z��d��e��f��g��hԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ�������жϳ���Ԫ�ػش��������⣺

�� �Ƚ�y��z��d����̬�⻯����ȶ���ǿ���ǣ�_______��________��________���û�ѧʽ��ʾ��
�� �ɱ�������Ԫ�ص�ԭ�Ӱ�1��1��ɵĻ�����A��A�мȺ����Ӽ��ֺ��Ǽ��Թ��ۼ��������ʽΪ_____��
�� ��������Ԫ�ص�ԭ���������£����в��Ǻ�fͬһ�������____________
a.5 b. 21 c. 49 d. 81
���ܱ�ʾ��g��hԪ�طǽ�����ǿ�������ӷ���ʽ��______________���ܱ�ʾ��y��h����������ˮ���������ǿ�������ӷ���ʽ��______________��
��2��F��Cl��Br��Iλ�����ڱ���VIIA�塣ͨ������ʵ��Ƚϳ�±�������Ե�ǿ����ʵ�����£�

��ͨ��±�ؼ��û���Ӧ�Ƚ�������ǿ����ʵ����___________������д1��2��3��4��
�ڵμ�CCl4��Ŀ����_________________��
������ʵ���ܷ�˵���ȵ�������ǿ���壿�жϲ�˵���������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��Ƶ���ʵ��װ����֤SO2�����ʣ�ͨ������ʵ�飬���н��۱�����ȷ����

A. a������ɫ����֤SO2����������
B. b������ɫ����֤SO2���������������ͨ��
C. c������ɫ��ȥ����֤SO2Ư����
D. ����ʹ��Ũ��������β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mL 14.0 molL��1Ũ�����м�������ͭ����ַ�Ӧ���ռ�����״����4.48 L NO��NO2������壨������NO2��N2O4���ת��������μӷ�Ӧͭ������Ϊ
A. 6.4gB. 12.8gC. 16.0gD. 19.2g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ����������ڱ��е����λ������ͼ��ʾ����Yԭ�ӵ��������������ڲ��������3��������˵������ȷ����
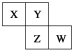
A. ԭ�Ӱ뾶��W>Z>Y>X
B. ����������Ӧˮ���������Z��Wǿ
C. Y����̬�⻯����ȶ��Խ�Z����
D. ����Ԫ�صĵ����У�Z���ۡ��е����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.01mol AlͶ�뵽100mL 3mol/L NaOH��Һ�г�ַ�Ӧ���ٵ���1mol/L H2SO4 120mL������
A. ��Һ��pH��7 B. �õ���������Һ
C. �õ�����Һ D. ���а�ɫ�������ɣ������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ú������Ҫ���� SiO2��Fe2O3��Al2O3 ������ȼú��������в����ķ�������ú�ҵ��ۺ����þ��� �ܴ�ļ�ֵ��
���о���Աͨ��ʵ��Է�ú����������Ԫ�صķ��빤�ս������о���
��1����������Һ�ֽ��ú�ң�ʹ���е�������Ԫ���ܳ�������ʵ�ֳ���������
��д��������Һ�� Fe2O3 ��Ӧ�����ӷ���ʽ_____��
����������õ���������Ҫ�ɷ���_____��
��2������1���������õ���Һ�м��뻹ԭ��ʹ Fe3+ת��Ϊ Fe2+������±�������ԭ��____��
���� | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
����������pH�� | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
��3��ʹ�ü��Խ����İ�ˮΪpH���ڼ������з���ʵ�顣
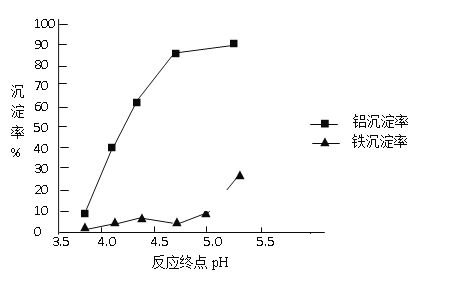
�ٰ�ˮʹ��Һ�������ӳ��������ӷ���ʽΪ_____��
�ڷ�Ӧ�յ��pH������������Ч����Ӱ������ͼ������ʵ������Ϊ�ﵽ�õķ���Ч������Ӧ�����п���pH�� ��Χ��______________��ѡ��÷�Χ��������___________________��
��NH4HSO4��H2SO4�����ʵ�����1��1������Ƴɽ�ȡҺ��220��ʱ���ɽ�������ú����Al2O3ת��Ϊ������� [NH4Al(SO4)2]��Ȼ����롢���ջ�ô�Al2O3�� ��֪������������ܽ����0��ʱ��S��5.2g��100��ʱ��S��421.9g����280��ʱ�ֽ���
��1���������Ͽ�֪��������������������ʷ���ķ�����_____��
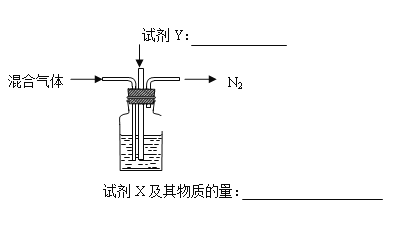
��2������ NH4Al(SO4)2 ͬʱ�õ�������壨NH3��N2��SO2��SO3��H2O������ 16 mol ������尴����װ�ñ���ȫ�����Ƶý�ȡҺ���뽫��ͼ���Լ�����ѧʽ���������ʵ�������������____________��___________
4NH4Al��SO4��2 ![]() 2Al2O3+5SO3��+3SO2��+2NH3��+N2��+5H2O��
2Al2O3+5SO3��+3SO2��+2NH3��+N2��+5H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�ڼ����Ԫ���У�﮵Ľ�������������ԭ����_______________________________________�����������ȼ�����ò���Ļ�ѧ��������________________��
(2)�����ڱ��У�﮵�������þ���ƣ�Ԥ����ڵ�����ȼ�յĻ�ѧ����ʽ��__________________________��̼��ﮡ�����﮵��ܽ�������Ϊ__________��__________(��������������������������)��
(3)�����Ȼ���д��ڵ���Ҫ��ʽΪ﮻�ʯ(LiAlSi2O6)�����ĸ[Li2F2Al2(SiO3)3]�ȡ�﮻�ʯ(LiAlSi2O6)�л��ϼ���ߵ�Ԫ�غ����ĸ[Li2F2Al2(SiO3)3]�зǽ�������ǿ��Ԫ����ɵĻ�����ĵ���ʽ_________������____________(�������ӻ��������������ۻ�������)�����³�ѹ�£�����_____̬��ԭ����_____________________��
(4)�������(LiBH4)���������(LiAlH4)������Ҫ��ԭ�������л��ϳ�����;�㷺���Ƚϰ뾶��r(Li+)_____r(H��)��(����>����<������=��)������_____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com