
【题目】A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸.请根据以上信息回答下列问题.
(1)C元素在元素周期表中的位置是________________
(2)画出B元素的离子结构示意图______________
(3)与E的氢化物分子所含电子总数相等的分子是_____(举一例,填化学式,下同)、离子是_________
(4)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为_________
(5)写出A元素与B元素形成化合物的化学式________
(6)下列可以判断C和D非金属性强弱的是_______
a.单质的熔点C比D低 b.单质与氢气反应C比D剧烈
c.气态氢化物稳定性C比D稳定 d.单质的密度C比D小
【答案】第二周期VIIA族 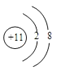 CH4(H2O HF Ne) OH-(NH4+ H3O+ NH2-) Cl2 + 2 OH- = Cl- + ClO- + H2O NaH bc
CH4(H2O HF Ne) OH-(NH4+ H3O+ NH2-) Cl2 + 2 OH- = Cl- + ClO- + H2O NaH bc
【解析】
A、B、C、D、E都为短周期元素,A是相对原子质量最小的,则A为H元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布,则B为Na元素,C为F元素;D在C的下一周期,可与B形成BD型离子化合物,则D为Cl元素;E和C为同一周期元素,其最高价氧化物的水化物为强酸,则E为N元素,据此进行解答。
根据上述分析,A为H元素,B为Na元素,C为F元素,D为Cl元素,E为N元素。
(1)C为F元素,在元素周期表中位于第二周期VIIA族,故答案为:第二周期VIIA族;
(2)B为Na元素,B元素的离子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(3)E为N元素,E的氢化物为氨气,与氨气分子所含电子总数相等的分子有CH4、H2O、HF、Ne等,离子有OH-、NH4+、H3O+、NH2-、Mg2+、Al3+、Na+等,故答案为:CH4(H2O、HF、Ne);OH-(NH4+、H3O+、NH2-、Mg2+、Al3+、Na+);
(4)D的单质为氯气,B的最高价氧化物对应的水化物为NaOH,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(5)A元素与B元素形成化合物为氢化钠,化学式为NaH,故答案为:NaH;
(6)a.单质的熔点与非金属性强弱无关,故a错误;b.非金属性越强,单质越容易与氢气化合,因此单质与氢气反应剧烈,说明非金属性:C>D,故b正确;c.非金属性越强,气态氢化物越稳定,稳定性C>D,说明非金属性:C>D,故c正确;d.单质的密度与非金属性强弱无关,故d错误;,故答案为:bc。


科目:高中化学 来源: 题型:
【题目】下列有关合金的叙述中正确的是( )
A.合金的密度比各成分金属小
B.合金的抗腐蚀性能都很好
C.合金的导电性比各成分金属强
D.合金的种类和性能与成分有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是

A. a棉球褪色,验证SO2具有氧化性
B. b棉球褪色,验证SO2具有酸性氧化物的通性
C. c棉球蓝色褪去,验证SO2漂白性
D. 可以使用浓硫酸吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
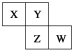
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性Z比W强
C. Y的气态氢化物的稳定性较Z的弱
D. 四种元素的单质中,Z的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.01mol Al投入到100mL 3mol/L NaOH溶液中充分反应后,再滴入1mol/L H2SO4 120mL,其结果
A. 溶液的pH<7 B. 得到澄清透明溶液
C. 得到浑浊液 D. 先有白色沉淀生成,后逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某稻壳灰的成分为
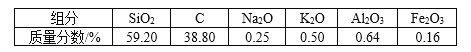
通过如下流程可由稻壳灰制备较纯净的二氧化硅。

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中属于两性氧化物的是________。
(2)步骤①中涉及SiO2的离子反应方程式为______________。
(3)滤渣A的成分有________和_________(填化学式)。
(4)滤渣B的成分是________(填化学式)。
(5)过滤所需的玻璃仪器除烧杯和玻璃棒外,还有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰(主要含有 SiO2、Fe2O3、Al2O3 等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有 很大的价值。
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。
①写出硫酸溶液与 Fe2O3 反应的离子方程式_____。
②初步分离得到的滤渣主要成分是_____。
(2)向(1)分离所得的滤液中加入还原剂使 Fe3+转化为 Fe2+,结合下表分析其原因____。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验。
①氨水使滤液中铝离子沉淀的离子方程式为_____。
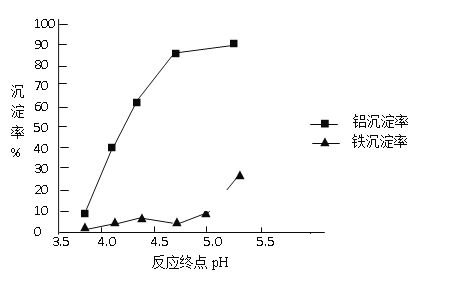
②反应终点的pH对铝和铁分离效果的影响如下图。根据实验结果,为达到好的分离效果,反应过程中控制pH的 范围是______________,选择该范围的理由是___________________。
Ⅱ.NH4HSO4和H2SO4按物质的量比1∶1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵 [NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3。 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g。②280℃时分解。
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是_____。
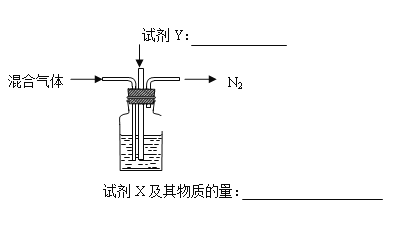
(2)煅烧 NH4Al(SO4)2 同时得到混合气体(NH3、N2、SO2、SO3、H2O)。若 16 mol 混合气体按如下装置被完全吸收制得浸取液,请将下图中试剂(化学式)及其物质的量补充完整。____________,___________
4NH4Al(SO4)2 ![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化的主要原理为:2NO+2CO![]() N2+2CO2 ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。能判断该反应达到平衡状态的标志是
N2+2CO2 ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。能判断该反应达到平衡状态的标志是
A. 在单位时间内生成1mol CO2的同时消耗了lmol CO
B. 混合气体的密度不再改变
C. 混合气体的平均相对分子质量不再改变
D. 相同时间内,形成CO2分子内键的数目是断开N2分子内键的数目的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A原子的质量为ag,12C原子的质量为bg,NA为阿伏加德罗常数,下列说法正确的是( )
A. A元素的相对原子质量为12a/bB. mgA原子的物质的量为(m/aNA)mol
C. 该原子的摩尔质量为aNAgD. ng该A原子所含的中子数与质子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com