
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
![]()
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
(1)A的电子式为___。
(2)在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为___。
(3)工业上常用过量的Na2CO3溶液吸收C,生成等物质的量的两种硝酸盐,该反应的离子方程式为___。
Ⅱ.若A、C、W都是常见气体,C是导致酸雨的主要气体,常温下A与C反应生成B,则该反应的化学方程式为___。某化学活动小组将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:____。
Ⅲ.A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
(1)若将标准状况下2.24L的W通入150mL1mol·L-1的A溶液中,充分反应。总反应的离子方程式为____。
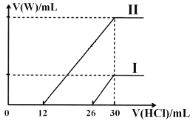
(2)向两份30mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.2mol·L-1盐酸,如图所示,Ⅰ和Ⅱ分别为向M、N溶液中加入盐酸的体积V(HCl)与产生W气体的体积V(W)的关系。则M、N两溶液中相同溶质的物质的量之比为___。
【答案】![]() 8NH3+6NO2
8NH3+6NO2![]() 7N2+12H2O 2NO2+2CO32-+H2O ===NO3-+NO2-+2HCO3- 2H2S+SO2=3S↓+2H2O 2H2SO3+O2=4H++2SO42- 2CO2+3OH-=CO32-+HCO3-+H2O 1∶3
7N2+12H2O 2NO2+2CO32-+H2O ===NO3-+NO2-+2HCO3- 2H2S+SO2=3S↓+2H2O 2H2SO3+O2=4H++2SO42- 2CO2+3OH-=CO32-+HCO3-+H2O 1∶3
【解析】
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。则A是氨气、B是一氧化氮、C是二氧化氮、W是氧气、D是硝酸。
Ⅱ.若A、C、W都是常见气体,C是导致酸雨的主要气体,C是二氧化硫,则A是硫化氢、B是S、W是氧气;
Ⅲ.A、B、C三种物质的溶液均显碱性,焰色反应均为黄色,说明都含钠元素;C常作面包和糕点的发泡剂,受热分解可生成B,则C是碳酸氢钠,B是碳酸钠,W是二氧化碳,A是氢氧化钠。
Ⅰ.(1)A是氨气,电子式为![]() 。
。
(2)在催化剂作用下,氨气与二氧化氮反应生成的两种无污染物质是氮气和水,该反应化学方程式为8NH3+6NO2![]() 7N2+12H2O。
7N2+12H2O。
(3)Na2CO3溶液吸收二氧化氮,生成等物质的量的两种硝酸盐,根据得失电子守恒,生成的两种硝酸盐是硝酸钠和亚硝酸钠,该反应的离子方程式为2NO2+2CO32-+H2O ===NO3-+NO2-+2HCO3-。
Ⅱ.常温下H2S与SO2发生氧化还原反应生成单质硫,该反应的化学方程式为2H2S+SO2=3S↓+2H2O。亚硫酸被氧化为硫酸,所以酸雨的pH呈减小趋势,反应的离子方程式是2H2SO3+O2=4H++2SO42-。
Ⅲ.(1)标准状况下,2.24L二氧化碳的物质的量是0.1mol, 150mL1mol·L-1的氢氧化钠溶液中氢氧化钠的物质的量是0.15mol,氢氧化钠和二氧化碳的比是3:2,根据元素守恒,反应生成0.5mol碳酸钠和0.5mol碳酸氢钠。反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O。
(2)碳酸钠溶液中逐滴滴入盐酸,依次发生反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O;
依据情况Ⅰ可知,26-30段为碳酸氢钠与盐酸反应,则溶液中碳酸钠消耗的盐酸体积为30-26=4ml,说明溶质为碳酸钠与氢氧化钠混合物,依据方程式:Na2CO3+HCl=NaHCO3+NaCl,碳酸钠的物质的量为:0.004L×0.2molL-1=0.0008mol;
依据情况Ⅱ知,12-30段为碳酸氢钠与盐酸反应,若溶质为碳酸钠则溶液中碳酸钠消耗的盐酸体积为30-12=18mL,而Ⅱ中0-12mL<18mL,说明Ⅱ中溶质为碳酸钠和碳酸氢钠,前12mL盐酸为碳酸钠与盐酸反应生成碳酸氢钠,依据Na2CO3+HCl=NaHCO3+NaCl,碳酸钠的物质的量为:0.012L×0.2molL-1=0.0024mol;所以M、N两溶液中相同组分溶质碳酸钠的物质的量之比为:0.0008mol;0.0024mol=1:3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个 ( )
①重水的化学式为T2O
②CO2的比例模型:![]()
③H2O2的电子式:![]()
④硅酸盐Ca2 Mg5 Si8 O22(OH)2可用氧化物形式表示为:2CaO﹒5MgO﹒8SiO2 ﹒H2O
⑤硅胶有吸水性,是常用的食品干燥剂
⑥医疗上常用乙醇体积分数为95%的酒精杀菌消
⑦聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
⑧水中的钢闸门连接电源的负极属于牺牲阳极的阴极保护法
⑨食盐可作调味剂,也可作食品防腐剂
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C6H6O)是一种重要的化工原料,广泛用于制造树脂、医药等。
Ⅰ.以A、B为原料合成扁桃酸衍生F的路线如下。

(1)A的名称是____;B的结构简式是____。
(2)C(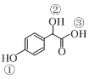 )中①~③羟基氢原子的活性由强到弱的顺序是____。
)中①~③羟基氢原子的活性由强到弱的顺序是____。
(3)D的结构简式是____。
(4)写出F与过量NaOH溶液反应的化学方程式:___________。
(5)若E分子中含有3个六元环,则E的结构简式是________。
Ⅱ.以A为原料合成重要的医药中间体K的路线如下。
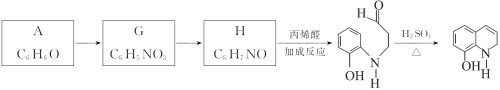
(6)G→H的反应类型是__________。
(7)一定条件下,K与G反应生成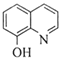 、H和水,化学方程式是__________。
、H和水,化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。利用常用的酸、碱和工业生产中的废铁屑,设计如下工艺流程,从废水中回收金,并生产一定量的铁红和氧化铜。
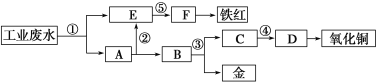
下列说法不正确的是( )
A.标号①②③处发生的反应均为氧化还原反应
B.标号③处加入的相应物质是稀硝酸或稀硫酸
C.标号①处发生的离子反应最多有三个
D.铁红的化学式为Fe2O3,工业上常用作红色颜料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24L三氧化硫中所含分子数约为0.1NA
B.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8%
C.一定温度下,1moLFeCl3可生成NA个Fe(OH)3胶体颗粒
D.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________。
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
18K金成分 | Au | Ag |
含量(质量分数) | 75.00% | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是( )

A.实验I中溶液红色褪去,说明发生了反应H++OH-![]() H2O
H2O
B.实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中仍然存在大量的Na+与OH
C.实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应2H++SO42-+Ba2++2OH-= 2H2O+BaSO4↓
D.将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出(溶液体积变化忽略不计),所得溶液Q中的![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 溶液Q比原溶液增重了1.92g.
B. Q中n(Cu2+):n(Fe3+)=3:4
C. 反应中转移的电子数为0.04mol
D. n(Cu2+)=0.03mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移6 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com