
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24L三氧化硫中所含分子数约为0.1NA
B.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8%
C.一定温度下,1moLFeCl3可生成NA个Fe(OH)3胶体颗粒
D.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移NA个电子
【答案】B
【解析】
A. 标况下,三氧化硫是固体,不能用22.4L/mol计算SO3物质的量,2.24LSO3物质的量不是1mol,含有SO3分子数不是0.1NA,故A错误;
B. 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为![]() ×100%(ρ浓、ρ稀分别为浓硫酸、稀硫酸的密度),硫酸密度大于水,加水稀释时密度改变,硫酸浓度越小密度越小,ρ浓>ρ稀,则稀释后硫酸的质量分数大于9.8%,故B正确;
×100%(ρ浓、ρ稀分别为浓硫酸、稀硫酸的密度),硫酸密度大于水,加水稀释时密度改变,硫酸浓度越小密度越小,ρ浓>ρ稀,则稀释后硫酸的质量分数大于9.8%,故B正确;
C. Fe(OH)3胶体粒子是由Fe(OH)3“分子”聚合成的较大颗粒,1molFeCl3完全水解,产生Fe(OH)3胶体粒子小于NA,故C错误;
D. H2O2中O为-1价,每个O得到一个电子变成-2价,即反应每生成1molO2转移2mol电子,32gO2就是1molO2,反应中转移2NA个电子,故D错误;
答案是B。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】有机物H是一种中枢神经兴奋剂,其合成路线如图所示。
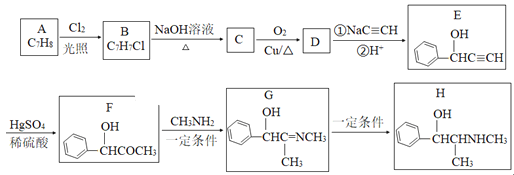
请回答下列题:
(1)A的化学名称为___,C的结构简式为___。
(2)E中官能团的名称为___。B→C、G→H的反应类型分别为___、__。
(3)D分子中最多有___个原子共平面。
(4)写出C→D反应的化学方程式为___。
(5)同时满足下列条件的E的同分异构体有___种(不考虑立体异构)。
①与E具有相同官能团;②苯环上有三个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明C2H5X(X=Cl、Br或 I)中存在溴原子,某同学设计如下实验:
Ⅰ.向C2H5X中加入硝酸银溶液,充分振荡后静置,液体分为两层,均为无色溶液;
Ⅱ.向C2H5X中加入氢氧化钠溶液,充分振荡后静置,液体分为两层,均为无色溶液;
Ⅲ.取Ⅱ中……。
(1)Ⅰ为对照实验,目的是_______。
(2)写出Ⅱ中的化学方程式:_______。
(3)补全Ⅲ中的实验操作及现象:_______,说明C2H5X中含溴原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
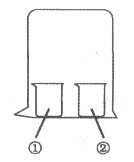
①中的物质 | ②中的物质 | 预测①的现象 | |
A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
C | MgCl2溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成___而使Cu2O产率降低。
(2)已知:①2Cu(s)+![]() O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=___。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
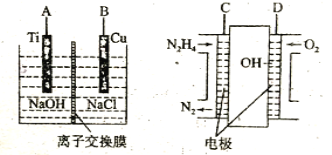
①上述装置中B电极应连___电极(填“C”或“D”)。
②该离子交换膜为___离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为___。
③原电池中负极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
![]()
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
(1)A的电子式为___。
(2)在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为___。
(3)工业上常用过量的Na2CO3溶液吸收C,生成等物质的量的两种硝酸盐,该反应的离子方程式为___。
Ⅱ.若A、C、W都是常见气体,C是导致酸雨的主要气体,常温下A与C反应生成B,则该反应的化学方程式为___。某化学活动小组将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:____。
Ⅲ.A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
(1)若将标准状况下2.24L的W通入150mL1mol·L-1的A溶液中,充分反应。总反应的离子方程式为____。
(2)向两份30mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.2mol·L-1盐酸,如图所示,Ⅰ和Ⅱ分别为向M、N溶液中加入盐酸的体积V(HCl)与产生W气体的体积V(W)的关系。则M、N两溶液中相同溶质的物质的量之比为___。
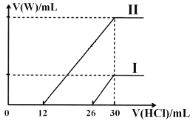
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应既不属于氧化还原反应又不属于四种基本反应类型的是( )
A.Cl2+2KBr=Br2+2KClB.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.3O2 ![]() 2O3D.2CO+O2
2O3D.2CO+O2![]() 2CO2
2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是_____。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2—N2+HCl
①该反应中被氧化的元素是___(填元素名称),氧化剂是__(填化学式)。
②配平该方程式:____NH3+ ____Cl2—____N2+____HCl
③工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是______,产生该现象的反应方程式为___。
(3)“地康法”制氯气的反应原理图示如下:
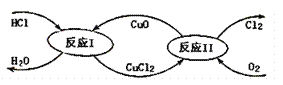
①反应I的化学方程式为____。
②若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用氮气、氧化铝和活性炭在高温下制取氮化铝。 请回答下列问题:
(1)请写出制取氮化铝的化学方程式________。
制得的AlN样品仅含有Al2O3杂质,已知:AlN+NaOH+H2O=NaAlO2+NH3↑为测定AlN含量,设计如下三种实验方案。(测定过程均忽略NH3在强碱溶液中的溶解)
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
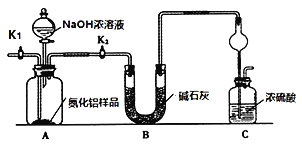
实验步骤:组装好实验装置,检查装置气密性并加入实验药品,关闭K1,打开K2 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。
(2)图中C装置中球形干燥管的作用是________。
(3)通入氮气的目的是_______。
(4)图中装置会导致测定结果_______(填“偏高”“偏低”或“无影响”)。
(方案2)用如图装置测定mg样品中AlN的纯度(部分夹持装置已略去)。
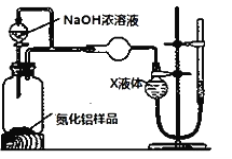
(5)为测定生成气体的体积,量气装置中的X液体可以是___(填字母)
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(6)若mg样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则AlN的质量分数是______。若其他操作均正确,但反应结束后读数时,右侧量气管中液面高于左侧球型管中液面,则最后测得AlN的质量分数会_____(填“偏高”“偏低”或“无影响”)。
(方案3)按以下步骤测定样品中A1N的纯度:(过滤时使用无灰滤纸过滤)
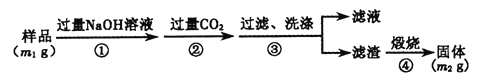
(7)步骤②生成沉淀的离子方程式为_______。
(8)样品中A1N的质量分数为_______(用含m1、m2的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com