
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成___而使Cu2O产率降低。
(2)已知:①2Cu(s)+![]() O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=___。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
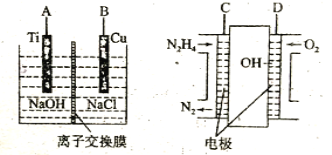
①上述装置中B电极应连___电极(填“C”或“D”)。
②该离子交换膜为___离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为___。
③原电池中负极反应式为___。
【答案】Cu +34.5kJ·mol-1 D 阴 2Cu-2e-+2OH-=Cu2O+H2O N2H4-4e-+4OH-=N2↑+4H2O
【解析】
(1)碳粉能把氧化铜还原为铜粉;
(2)利用盖斯定律计算2CuO(s)+C(s)=Cu2O(s)+CO(g)的焓变;
(3)根据装置图,Cu生成Cu2O,金属铜失电子发生氧化反应,铜为阳极;肼燃料电池中通入氧气的一极发生还原反应,所以D是正极、C是负极。
(1)碳粉能把氧化铜还原为铜粉,若控温不当易生成Cu而使Cu2O产率降低;
(2)①2Cu(s)+![]() O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
根据盖斯定律①+②-③×2得:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=+34.5kJ·mol-1;
(3)①根据装置图,Cu生成Cu2O,铜元素失电子发生氧化反应,铜为阳极,B电极连正极,应与肼燃料电池的D电极相连;
②根据题意,需要通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,所以该离子交换膜为阴离子交换膜;阳极铜失电子生成Cu2O,电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O;
③肼燃料电池中,燃料肼在负极失电子生成氮气和水,负极反应方程式是N2H4-4e-+4OH-=N2↑+4H2O。


科目:高中化学 来源: 题型:
【题目】某有机物的结构是:关于它的性质的描述正确的是( )
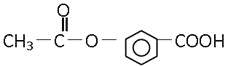
①能发生加成反应; ②能溶解于NaOH溶液中; ③能水解生成两种有机物;
④不能使溴水褪色; ⑤能发生酯化反应; ⑥有酸性
A. ①②③B. ②③⑤C. 仅⑥D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用KClO3和50mL浓盐酸反应制取Cl2,反应原理如下:
KClO3+HCl→KCl+Cl2↑+H2O
(1)配平上述化学方程式并用双线桥标出电子转移方向与数目__________________;
(2)浓盐酸在上述反应中表现出来的性质是__(填选项编号)
A.只有氧化性 B.只有还原性 C.还原性和酸性 D.氧化性和酸性
(3)若产生0.1mol Cl2,则转移电子的物质的量为_______(保留两位小数)
(4)若反应中HCl的利用率只有50%,当氧化产物比还原产物比还原产物多7.1g时,浓盐酸的物质的量浓度为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图:
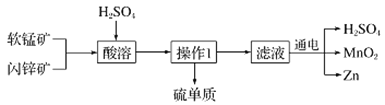
下列说法不正确的是( )
A.干电池是一种将化学能转变为电能的装置
B.酸溶时,ZnS作还原剂,每析出12.8gS沉淀,共转移0.8mol电子
C.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池的负极为锌,正极为氧化银,电解质是KOH,电池反应为Zn+Ag2O+H2O=Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。
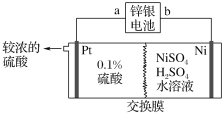
下列说法正确的是( )
A.装置中使用阴离子交换膜
B.锌银电池a极反应式为Ag2O+H2O+2e-=2Ag+2OH-
C.左侧若加入稀盐酸,电解后得到比较浓的盐酸
D.若锌银电池溶解13g锌,则镍极净增质量最多为5.9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24L三氧化硫中所含分子数约为0.1NA
B.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8%
C.一定温度下,1moLFeCl3可生成NA个Fe(OH)3胶体颗粒
D.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
B.向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+
C.将Ca(HCO3)2溶液与少量Ca(OH)2溶液混合:OH+Ca2++HCO=CaCO3↓+H2O
D.往苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O
+CO2+H2O![]() 2
2![]() +CO
+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为![]() ,判断下列说法中不正确的是
,判断下列说法中不正确的是
A. 它可以使酸性KMnO4溶液褪色
B. 它可发生取代反应、加成反应、加聚反应、氧化反应
C. 它与氢气发生加成反应,最多可以消耗5mol氢气
D. 1mol该有机物燃烧消耗氧气为18.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式_______________________________________。
(2)已知:Se+2H2SO4(浓)![]() 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O![]() Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_________________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3![]() Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3![]() Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com