
����Ŀ��ʵ���ҿ�����KClO3��50mLŨ���ᷴӦ��ȡCl2����Ӧԭ�����£�
KClO3+HCl��KCl+Cl2��+H2O
(1)��ƽ������ѧ����ʽ����˫���ű������ת�Ʒ�������Ŀ__________________��
(2)Ũ������������Ӧ�б��ֳ�����������__����ѡ���ţ�
A��ֻ�������� B��ֻ�л�ԭ�� C����ԭ�Ժ����� D�������Ժ�����
(3)������0.1mol Cl2����ת�Ƶ��ӵ����ʵ���Ϊ_______��������λС����
(4)����Ӧ��HCl��������ֻ��50%������������Ȼ�ԭ����Ȼ�ԭ�����7.1gʱ��Ũ��������ʵ���Ũ��Ϊ__________��
���𰸡�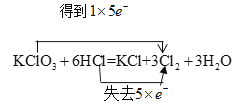 C 0.17mol 12mol/L
C 0.17mol 12mol/L
��������
(1)������ԭ��Ӧ�У����ϼ۽���ֵ=���ϼ�����ֵ=ת�Ƶ����������ݻ��ϼ۱仯��ȷ������ת�Ʒ������Ŀ��
(2)�����ڷ�Ӧ�в���ת��Ϊ����������ת��Ϊ�Ȼ��أ��ݴ˻ش�
(3)���ݻ��ϼ�������Ϸ���ʽ����ת�Ƶ��ӵ����ʵ�����
(4)����3mol�����У�����������2.5molCl2�Ȼ�ԭ����0.5mol��2mol������������Ȼ�ԭ����Ȼ�ԭ�����7.1g��0.1molʱ�����������������������c=![]() �����㡣
�����㡣
(1)��������ԭ��Ӧ�У��������ClԪ�ػ��ϼ۽��ͣ�������ClԪ�ػ��ϼ����ߣ����ϼ۽���ֵ=���ϼ�����ֵ=ת�Ƶ�����=5����˫���ŷ�������ת�Ʒ������ĿΪ��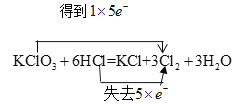 ��
��
(2)��������ԭ��Ӧ�У����ϼ�����ClԪ����������HCl�ڷ�Ӧ�б���������ʾ��ԭ�ԣ����в���������Ԫ�ػ��ϼ۲��䣬�������Ȼ��أ���ʾ���ԣ��ʴ�ΪC��
(3)������3molCl2����ת�Ƶ��ӵ����ʵ���Ϊ5mol������������0.1molCl2����ת�Ƶ��ӵ����ʵ���Ϊ0.17mol��
(4)����3mol�����У�����������2.5molCl2�Ȼ�ԭ����0.5mol��2mol������������Ȼ�ԭ����Ȼ�ԭ�����7.1g��0.1molʱ������������������0.15mol�����ĵ���������ʵ�����0.3mol����Ӧ��HCl��������ֻ��50%��������������ʵ�����0.6mol��Ũ��������ʵ���Ũ��Ϊ![]() =12mol/L��
=12mol/L��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ������صķ�Ӧ��Na+KCl ![]() K+NaCl���йطе���������£�
K+NaCl���йطе���������£�
���� | K | Na | KCl | NaCl |
�е㣨��C�� | 759 | 883 | 1420 | 1465 |
����˵������ȷ����
A.�÷�Ӧ˵����Na�Ľ�����ǿ��K
B.850��Cʱ���������ݳ���ƽ�������ƶ���KClת��������
C.������900��C���ռ������أ��صĴ��Ȼή��
D.�������к��������ƣ���ͨ���������ķ��������ᴿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A.1mol OH�����еĵ�����Ϊ9NA
B.��״���£�NO2��N2O4�Ļ����23g�к���NA����ԭ��
C.���³�ѹ�£�2.8gN2��2.24L CO������������Ϊ1.4NA
D.��״���£�22.4 L �Ҵ��к���NA���Ҵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������ͽ��۾���ȷ����
ѡ�� | ʵ����� | ���� | ���� |
A | ��˫��ˮ�ζ�KI-������Һ | ��Һ���� | �ﵽ�ζ��յ� |
B | ��ʳ�üӵ����м���ʳ��KI��Һ���ټ���CCl4������ | �²���Ϻ�ɫ | ��ʳ�üӵ����к���KIO3 |
C | ��ʪ��ĵ��۵⻯����ֽ����NO2�������� | ��ֽ���� | ������Ϊ������ |
D |
| ����Թ���dz��ɫ���� | �л����к�����ԭ�� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.�Ӻ�ˮ�õ��Ĵ�ʳ��ˮ�г���Ca2����Mg2����SO42-����Ҫ�����ᴿ�����к�����CaCl2��MgSO4�Ĵ�ʳ��ˮ���ڳ�ȥ���������ɳ֮��Ҫ��4���Լ������ᡢ��Na2CO3����NaOH����BaCl2����ȥʳ��ˮ��Ca2����Mg2����SO42-���ᴿ�IJ�������ͼ����Լ��������ͼ��
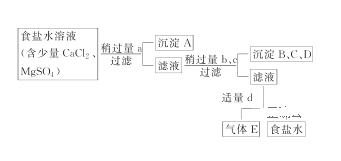
ͼ��a��b��c��d�ֱ��ʾ����4���Լ��е�һ�֣��Իش�
(1)����A��������________��
(2)�Լ�d��________���ж��Լ�d�Ѿ������ķ�����___________________��
��������d����Һ�з�����Ӧ�����ӷ���ʽΪ___________________________��
(3)�����������������˳�����A��B��C��Dʱ�����õ�________(�����)�������۵�������________��
��.��ˮ�������ɺ�ˮ��õ�ˮ�ij��÷���֮һ����ʵ���������һ������װ�ÿ϶���Ҫ���������е�һ���֣�����ȷ����________(�����)��
��.�������������ʾ����������Եõ���ˮ�����ӵ�ˮ����ȡ�⣬��Ҫ���������е�________(�����)������������Ϊ________����õ�ˮ�м������Ȼ�̼����ȡ�ⵥ�ʵ�ʵ�����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ֤��C2H5X��X=Cl��Br�� I���д�����ԭ�ӣ�ijͬѧ�������ʵ�飺
����C2H5X�м�����������Һ��������ã�Һ���Ϊ���㣬��Ϊ��ɫ��Һ��
����C2H5X�м�������������Һ��������ã�Һ���Ϊ���㣬��Ϊ��ɫ��Һ��
��ȡ����������
(1)��Ϊ����ʵ�飬Ŀ����_______��
(2)д�����еĻ�ѧ����ʽ��_______��
(3)��ȫ���е�ʵ�����������_______��˵��C2H5X�к���ԭ�ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ����Ҫ�Ļ�ѧ��Ӧ��������������������������ڡ�
��1����֪��Ӧ��BaSO4��C����BaS��CO��
����ƽ�÷�Ӧ___��
������2.33gBaSO4������Ӧ����Ӧ������ת�Ƶ��ӵ���Ŀ��__����״���£�����һ����̼___L��
��2����֪��Ӧ��Cu+HNO3(ϡ)����Cu(NO3)2+NO��+H2O��
����ƽ���á�˫���ŷ�����ʾ������Ӧ�е���ת�Ƶķ������Ŀ___��
�ڸ÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ__��д���÷�Ӧ�����ӷ���ʽ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����a | ��̿���ڸ��������»�ԭCuO |
����b | ��ⷨ����ӦΪ2Cu+H2O |
��1����ҵ�ϳ��÷���b��ȡCu2O�������÷���a����ԭ���Ƿ�Ӧ���������ƣ������²���������___��ʹCu2O���ʽ��͡�
��2����֪����2Cu(s)+![]() O2(g)=Cu2O(s) ��H1=��169kJ��mol��1
O2(g)=Cu2O(s) ��H1=��169kJ��mol��1
��C(s)+![]() O2(g)=CO(g) ��H2=��110.5 kJ��mol��1
O2(g)=CO(g) ��H2=��110.5 kJ��mol��1
��Cu(s)+![]() O2(g)=CuO(s) ��H3=��157 kJ��mol��1
O2(g)=CuO(s) ��H3=��157 kJ��mol��1
��a�з����ķ�Ӧ��2CuO(s)��C(s)=Cu2O(s)��CO(g)����H=___��
��3������b������ȼ�ϵ��Ϊ��Դ��ͨ�����ӽ���Ĥ��ⷨ���Ƶ��Һ��OH����Ũ�����Ʊ�����Cu2O��װ����ͼ��ʾ��
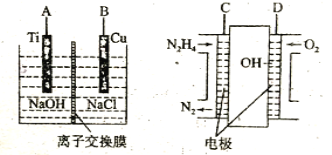
������װ����B�缫Ӧ��___�缫(�C����D��)��
�ڸ����ӽ���ĤΪ___���ӽ���Ĥ(�����������)���õ��ص�������ӦʽΪ___��
��ԭ����и�����ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO��H2��ɵĻ������2.4g��������O2�г��ȼ�պ����ɵ����в���ͨ��������Na2O2���壬Na2O2�������ӵ�����Ϊ
A. 1.2g B. 2.4 g C. 3.6![]() g D. ������
g D. ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com