
【题目】氧化还原反应是重要的化学反应,在人类的生产和生活中无处不在。
(1)已知反应:BaSO4+C——BaS+CO↑
①配平该反应___。
②若有2.33gBaSO4发生反应,则反应过程中转移电子的数目是__,标准状况下,生成一氧化碳___L。
(2)已知反应:Cu+HNO3(稀)——Cu(NO3)2+NO↑+H2O;
①配平并用“双线桥法”表示上述反应中电子转移的方向和数目___。
②该反应中氧化剂与还原剂的物质的量之比为__;写出该反应的离子方程式__。
【答案】BaSO4+4C=BaS+4CO↑ 0.08NA 0.896L  2:3 3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O
2:3 3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O
【解析】
根据氧化还原反应中得失电子守恒配平反应并用双线桥法表示;根据气体摩尔体积及反应方程式进行相关计算;根据离子方程式书写规则书写相关离子反应方程式。
(1)①反应中S元素化合价降低8,C元素化合价升高2,根据转移电子数守恒,配得C与CO系数为4,再运用观察法配平得:BaSO4+4C=BaS+4CO↑,故答案为BaSO4+4C=BaS+4CO↑;
②n(BaSO4)=![]() ,S元素化合价由+6降低为-2,则转移电子为0.01mol×8=0.08mol,即0.08NA;V(CO)=0.01mol×4×22.4L/mol=0.896L,故答案为0.08NA;0.896L;
,S元素化合价由+6降低为-2,则转移电子为0.01mol×8=0.08mol,即0.08NA;V(CO)=0.01mol×4×22.4L/mol=0.896L,故答案为0.08NA;0.896L;
(2)①该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,再根据原子守恒配平方程式,用双线桥标出该反应电子转移的方向和数目为: ,故答案为
,故答案为 ;
;
②该反应中还原剂为Cu,氧化剂为HNO3,参加反应的硝酸中只有1/4被还原,所以该反应中氧化剂与还原剂的物质的量之比为2:3,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O,故答案为2:3;3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 酸性溶液中KIO3与KI反应生成I2:IO![]() +I-+6H+===I2+3H2O
+I-+6H+===I2+3H2O
B. 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-===2BaSO4↓+Al(OH)3↓
C. 用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2===2NH4++SO32-+H2O
D. 用铜作电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),实验测得的不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得的不同温度下的平衡数据列于下表:
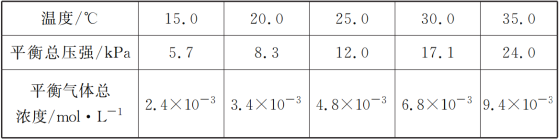
①可以判断该分解反应已经达到平衡的是___________
A. 2v(NH3)=v(CO2)
B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时氨基甲酸铵的分解平衡常数表达式为________;平衡常数为________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_______ (填“增加”“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH________0(填“>”“=”或“<”),熵变ΔS______0(填“>”“=”或“<”)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。
NH4HCO3+NH3·H2O。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
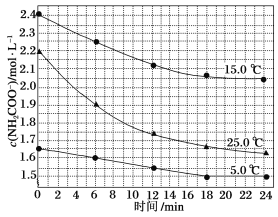
⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:_______
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25.0 ℃时反应物的起始浓度较小,但0~6 min的平均反应速率(曲线的斜率)仍比15.0 ℃时的________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用KClO3和50mL浓盐酸反应制取Cl2,反应原理如下:
KClO3+HCl→KCl+Cl2↑+H2O
(1)配平上述化学方程式并用双线桥标出电子转移方向与数目__________________;
(2)浓盐酸在上述反应中表现出来的性质是__(填选项编号)
A.只有氧化性 B.只有还原性 C.还原性和酸性 D.氧化性和酸性
(3)若产生0.1mol Cl2,则转移电子的物质的量为_______(保留两位小数)
(4)若反应中HCl的利用率只有50%,当氧化产物比还原产物比还原产物多7.1g时,浓盐酸的物质的量浓度为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了下图的实验装置。回答下列问题:

(1)①装置中仪器a的名称是____________________。
(2)写出装置①中反应方程式并标出双线桥____________________。
(3)装置②中饱和食盐水的作用是__________________________。
(4)装置③制取漂白粉的化学方程式是_____________。
(5)漂白粉的漂白原理是___________________________(用化学方程式表示)。
(6)化学实验中常用湿润的淀粉碘化钾试纸检验是否有Cl2产生,写出检验过程中发生的反应方程式 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图:
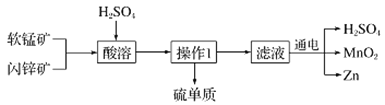
下列说法不正确的是( )
A.干电池是一种将化学能转变为电能的装置
B.酸溶时,ZnS作还原剂,每析出12.8gS沉淀,共转移0.8mol电子
C.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池的负极为锌,正极为氧化银,电解质是KOH,电池反应为Zn+Ag2O+H2O=Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。
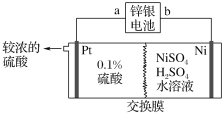
下列说法正确的是( )
A.装置中使用阴离子交换膜
B.锌银电池a极反应式为Ag2O+H2O+2e-=2Ag+2OH-
C.左侧若加入稀盐酸,电解后得到比较浓的盐酸
D.若锌银电池溶解13g锌,则镍极净增质量最多为5.9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
B.向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+
C.将Ca(HCO3)2溶液与少量Ca(OH)2溶液混合:OH+Ca2++HCO=CaCO3↓+H2O
D.往苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O
+CO2+H2O![]() 2
2![]() +CO
+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是

A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com