
【题目】在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是

A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
【答案】B
【解析】试题分析: A.根据装置图可知,从a进入的气体是含有SO2、O2、N2等的冷气,经过热交换器后从b处出来的是热的气体,成分与a处相同,正确;B.在c处出来的气体SO2、O2在催化剂表面发生反应产生的含有SO3及未反应的SO2、O2等气体,该反应是放热反应,当经过热交换器后被冷的气体降温,SO3被部分分离出来,而且混合气体再次被催化氧化,故二者含有的气体的成分含量不相同,错误;C.热交换器的作用是预热待反应的冷的气体,同时冷却反应产生的气体,为SO3的吸收创造条件,正确;D.C处气体经过热交换器后再次被催化氧化,目的就是使未反应的SO2进一步反应产生SO3,从而可以提高SO2的转化率,正确。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】“84消毒液”与硫酸溶液反应可以制取氯气,反应原理为:NaClO + NaCl + H2SO4 ![]() Na2SO4 + Cl2↑+ H2O; 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
Na2SO4 + Cl2↑+ H2O; 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
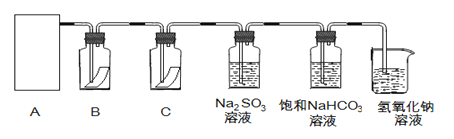
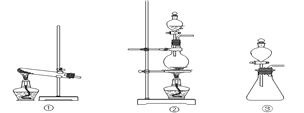
(1)从①、②、③装置中选择合适的制氯气装置(A处)___________ (填写序号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是__________;说明该装置存在明显的缺陷,请提出合理的改进的方法 _______________________________。
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,然后检验反应后溶液中是否含有SO42-。写出氯气与Na2SO3溶液反应的离子方程式 ________________,检验反应后溶液中含有SO42-的方法:取少量反应后溶液于试管中,先加入足量的_____至无明显现象,然后再加入少量____溶液有白色沉淀生成,说明含有SO42-。
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有 ________________ (填“盐酸”或“次氯酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链状有机物M(分子式为C4H6O2)在催化剂作用下可与H2发生加成反应生成有机物N(分子式为C4H8O2),下列有关说法不正确的是(均不考虑立体异构)( )
A. 若M属于羧酸类有机物,则M的结构有3种
B. 若M属于酯类有机物,则M的结构有4种
C. 若M属于羧酸类有机物,则M的加成产物N的结构有2种
D. 若M属于酯类有机物,则M的加成产物N的结构有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA.下列说法正确的是( )
A. 1L0.1molL﹣1NH4Cl溶液中,NH4+的数量为0.1NA
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
A. 用排水法收集铜粉与浓硝酸反应产生的NO2
B. 用氨水鉴别NaCl、MgCl2、A1C13、NH4C1四种溶液
C. 用酸性KMnO4溶液验证草酸的还原性
D. 加热氯化铵固体制备氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:A(g)+3B(g)2C(g);△H<0.有甲乙两个容积为0.5L的密闭容器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molC达到平衡时吸收热量为Q2kJ;已知Q2=3Q1 . 下列叙述正确的是( )
A.乙中的热化学方程式为2C(g)A(g)+3B(g);△H=+4Q2/3kJ/mol
B.反应达到平衡前,甲中始终有v正大于v逆 , 乙中始终有v正大于v逆
C.在该条件下,反应2C(g)A(g)+3B(g)的平衡常数为9×1.52(mol/L)2
D.乙中C的转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U,W,Y是原子序数依次增大的短周期主族元素,在周期表中的相对位置如右表;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
U | |||
W | Y |
(1)元素U的原子核外共有种不同能级的电子.
(2)能提高W与稀硫酸反应速率的方法是
a.使用浓硫酸 b.加热 c.加压 d.使用等质量的W粉末
(3)在恒容密闭容器中进行:2YO2(g)+O2(g) ![]() 2YO3(g)△H2=﹣190kJ/mol
2YO3(g)△H2=﹣190kJ/mol
①该反应 450℃时的平衡常数500℃时的平衡常数(填<,>或=).
②下列描述中能说明上述反应已达平衡的是
a.2ν(O2)正=ν(YO3)逆 b.气体的平均分子量不随时间而变化
c.反应时气体的密度不随时间而变化 d.反应时气体的分子总数不随时间而变化
③在一个固定容积为2L的密闭容器中充入0.20mol YO2和0.10molO2 , 半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=:平衡常数为 . 若继续通入0.20molYO2和0.10molO2 , 再次达到平衡后,YO3物质的量约为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO,NOx等)的污染是重要的科学研究课题.
(1)已知:N2(g)+O2(g)═2NO(g)△H1
N2(g)+3H2(g)2NH3(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=(用含△H1、△H2、△H3的式子表达)
(2)汽车尾气中的CO,NOx都需要除去,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知该反应在任何温度下都不能自发进行,因此该设想便不能实现.由此判断该反应的△H0
目前,在汽车尾气系统中装置催化转化器可以减少CO,NO的污染,其化学反应方程式为
(3)可用活性炭还原法处理氮氧化物.有关反应的化学方程式为:C(s)+2NO(g)N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
浓度/molL﹣1 | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
则,30min后,改变某一条件,平衡发生了移动,则改变的条件是;若升高温度,NO浓度将(填“增大”、“不变”或“减小”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com