
����Ŀ����84����Һ����������Һ��Ӧ������ȡ��������Ӧԭ��Ϊ��NaClO + NaCl + H2SO4 ![]() Na2SO4 + Cl2��+ H2O�� Ϊ̽�����������ʣ�ijͬѧ���ô�ԭ���������������������ʾ��ʵ��װ�ã�
Na2SO4 + Cl2��+ H2O�� Ϊ̽�����������ʣ�ijͬѧ���ô�ԭ���������������������ʾ��ʵ��װ�ã�
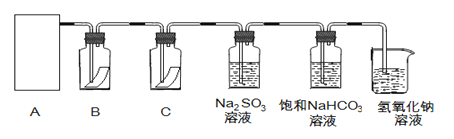
��1���Ӣ١��ڡ���װ����ѡ����ʵ�������װ�ã�A����___________ (��д���)��
��2��װ��B��C�����ηŵ��Ǹ���ĺ�ɫ������ʪ��ĺ�ɫ������ʵ������и�ͬѧ����װ��B�еIJ���Ҳ��ɫ����ԭ�������__________��˵����װ�ô������Ե�ȱ�ݣ�����������ĸĽ��ķ��� _______________________________��
��3��Ϊ����֤�����������ԣ�������ͨ��Na2SO3��Һ�У�Ȼ����鷴Ӧ����Һ���Ƿ���SO42-��д��������Na2SO3��Һ��Ӧ�����ӷ���ʽ ________________�����鷴Ӧ����Һ�к���SO42-�ķ�����ȡ������Ӧ����Һ���Թ��У��ȼ���������_____������������Ȼ���ټ�������____��Һ�а�ɫ�������ɣ�˵������SO42-��
��4������ͨ�뱥��NaHCO3��Һ�ܲ�����ɫ���壬��֪����:����>̼��>�����ᣬ��ʵ��֤��������ˮ��Ӧ���������к��� ________________ ������ᡱ�����ᡱ����
���𰸡� �� �����������к���ˮ�����ᷴӦ���ɴ����� ��װ��A��B֮������ʢ��Ũ�����ϴ��ƿ�������װ�ã� Cl2+SO32-+H2O=SO42-+2Cl-+2H+ ϡ���ᣨ��HCl��Һ�� BaCl2(������������) ����
����������1����NaClO+NaCl+H2SO4![]() Na2SO4+Cl2��+H2O��֪����Ӧ��Һ��μӣ���Ҫ���ȣ�����ѡװ�âڣ���2��װ��B�и������ɫ������ɫ��˵�������п��ܻ���������ˮ������������ˮ��Ӧ���ɴ������Ư�ף����Ӧ����A��B֮������ʢ��ŨH2SO4��ϴ��ƿ����ȥCl2�е�ˮ��������������������ų��������ӵĸ��ţ���˼��鷴Ӧ����Һ�к���SO42���ķ����ǣ�ȡ������Ӧ����Һ���Թ��У��ȼ���������ϡ����������������Ȼ���ټ�������BaCl2��Һ�а�ɫ�������ɣ�˵������SO42-����3��������������������Ϊ�����ƣ���������ԭΪCl-����Ӧ���ӷ���ʽΪCl2+SO32-+H2O��SO42-+2Cl-+2H+����4������ͨ��ˮ��Һ�ᷴӦ��������ʹ����ᣬ�������̼������ᣬ����ͨ�뱥��NaHCO3��Һ�ܲ�����ɫ���壬֤��������ˮ��Ӧ���������к������ᡣ
Na2SO4+Cl2��+H2O��֪����Ӧ��Һ��μӣ���Ҫ���ȣ�����ѡװ�âڣ���2��װ��B�и������ɫ������ɫ��˵�������п��ܻ���������ˮ������������ˮ��Ӧ���ɴ������Ư�ף����Ӧ����A��B֮������ʢ��ŨH2SO4��ϴ��ƿ����ȥCl2�е�ˮ��������������������ų��������ӵĸ��ţ���˼��鷴Ӧ����Һ�к���SO42���ķ����ǣ�ȡ������Ӧ����Һ���Թ��У��ȼ���������ϡ����������������Ȼ���ټ�������BaCl2��Һ�а�ɫ�������ɣ�˵������SO42-����3��������������������Ϊ�����ƣ���������ԭΪCl-����Ӧ���ӷ���ʽΪCl2+SO32-+H2O��SO42-+2Cl-+2H+����4������ͨ��ˮ��Һ�ᷴӦ��������ʹ����ᣬ�������̼������ᣬ����ͨ�뱥��NaHCO3��Һ�ܲ�����ɫ���壬֤��������ˮ��Ӧ���������к������ᡣ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe(OH)3����װ��U���У�����ʯī�缫����ֱ����Դ��ͨ��һ��ʱ����ֽ�����������������ƶ������������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ���ʵ�����CO��N2������˵���У�����������ԭ�Ӹ�����ȣ�������������������ȣ������ǵ�������ȡ���ȷ����
A. �٢� B. �٢� C. �ڢ� D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NOCl,�۵�:-64.5 ��,�е�:-5.5 ��)��һ�ֻ�ɫ����,��ˮ��ˮ�⡣�����ںϳ���������ý�����м���ȡ�ʵ���ҿ���������һ�������ڳ��³�ѹ�ºϳɡ�
��1�������ͬѧ���Ʊ�ԭ����NO��Cl2,�Ʊ�װ������ͼ��ʾ:

Ϊ�Ʊ��������������,�±���ȱ�ٵ�ҩƷ��:
װ�â� | װ�â� | ||
��ƿ�� | ��Һ©���� | ||
�Ʊ�����Cl2 | MnO2 | ��___ | ��___ |
�Ʊ�����NO | Cu | ��___ | ��___ |
��2������ͬѧ���ü����Ƶõ�NO��Cl2�Ʊ�NOCl,װ����ͼ��ʾ:

��װ������˳��Ϊa��________(�������������ҷ���,��Сд��ĸ��ʾ)��
��װ�â��������ɽ�һ������NO��Cl2��,��һ��������____________��
��װ�â���������____________��
��װ�â�������β��ʱ,NOCl������Ӧ�Ļ�ѧ����ʽΪ________________��
��3������ͬѧ��������,�����ˮ��Ũ������Ũ����Ļ��ᣬһ�������¸û���������������Ⱥ������� �÷�Ӧ�Ļ�ѧ����ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӻ�������Ʊ�1��4�����������������������й������йص�8����Ӧ���������������ﶼ����ȥ���� 
��1�������١���8������������ȡ����Ӧ����������ţ���ͬ����������ȥ��Ӧ���������ڼӳɷ�Ӧ���� ��
��2��д���������ʵĽṹ��ʽ��
B �� C �� D ��
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��
�� ��
�� ��
�� ��
�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ҵ�����Ϳ�����������Ҫ����;����ش��������⣺
��1����̬ Ni ԭ���У���������������ߵ��ܼ�����Ϊ_________���۲���ӵĹ������ʽΪ_________��
��2��Ni�����������ṹ��ͼ��ʾ��
A B
��A ���ۡ��е����B��ԭ��Ϊ_________��
��A���庬�л�ѧ��������Ϊ___________����ѡ����ĸ����
A������ B������ C����� D��������
��A������Nԭ�ӵ��ӻ���ʽ��_________��
��3�� �˹��ϳɵ��黯�������ڸ���ȱ�ݣ�ijȱ���黯�������ΪNi1.2As�� ���� Ni Ԫ��ֻ�У�2 �ͣ�3 ���ּ�̬�� ���ּ�̬����������Ŀ֮��Ϊ_________��
��4�� NiAs�ľ����ṹ��ͼ��ʾ��

�������ӵ���λ��Ϊ_________��
���������ӵ�������ֵΪNA�������ܶ�Ϊ �� g��cm��3����þ����������������֮��ľ���Ϊ_________pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ����ʵ��
��1��X��Y2��===X2����Y
��2��Z��2H2O![]() Z(OH)2��H2��
Z(OH)2��H2��
��3��Z2�����ӵ������Ա�X2����
��4����Y��W���缫��ɵ�ԭ��ط�ӦΪ��Y��2e��===Y2��
�ɴ˿�֪��X��Y��Z��W�Ļ�ԭ����ǿ������˳���ǣ���
A. X��Y��Z��W B. Y��X��W��Z
C. Z��X��Y��W D. Z��Y��X��W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ṥҵ�����У�Ϊ��������SO2��ת�������ܳ���������ܣ��������м����Ƚ������ĽӴ��ң�����ͼ��������˵���������

A. a��b�����Ļ������ɷֺ�����ͬ���¶Ȳ�ͬ
B. c��d�����Ļ������ɷֺ�����ͬ���¶Ȳ�ͬ
C. �Ƚ�������������Ԥ�ȴ���Ӧ�����壬��ȴ��Ӧ�������
D. c�����徭�Ƚ������ٴδ�������Ŀ�������SO2��ת����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com