
【题目】根据下列实验事实:
(1)X+Y2+===X2++Y
(2)Z+2H2O![]() Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+离子的氧化性比X2+弱
(4)由Y、W作电极组成的原电池反应为:Y-2e-===Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是()
A. X>Y>Z>W B. Y>X>W>Z
C. Z>X>Y>W D. Z>Y>X>W
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,可证明碳和浓硫酸反应放出气体SO2和CO2。
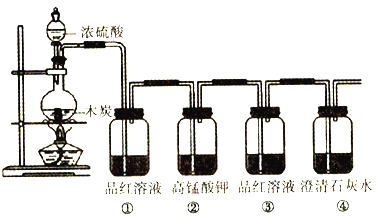
(1)木炭与浓H2SO4反应的化学方程式是_________________________________________,该反应的氧化剂为_______________,当转移2mol电子时,生成标准状况下的SO2和CO2共_______L。
(2)洗气瓶①、②中溶液褪色,体现二氧化硫的性质依次为_________(填序号)。
a.氧化性、还原性 b.漂白性、还原性 c.漂白性、氧化性 d.还原性、漂白性
(3)证明二氧化碳存在的现象为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”与硫酸溶液反应可以制取氯气,反应原理为:NaClO + NaCl + H2SO4 ![]() Na2SO4 + Cl2↑+ H2O; 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
Na2SO4 + Cl2↑+ H2O; 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
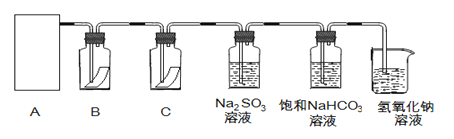
(1)从①、②、③装置中选择合适的制氯气装置(A处)___________ (填写序号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是__________;说明该装置存在明显的缺陷,请提出合理的改进的方法 _______________________________。
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,然后检验反应后溶液中是否含有SO42-。写出氯气与Na2SO3溶液反应的离子方程式 ________________,检验反应后溶液中含有SO42-的方法:取少量反应后溶液于试管中,先加入足量的_____至无明显现象,然后再加入少量____溶液有白色沉淀生成,说明含有SO42-。
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有 ________________ (填“盐酸”或“次氯酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值。下列有关说法正确的是( )
A. 1mol乙酸、乙醇和甲酸甲酯的混合物中含有的碳原子数为2NA
B. 46gNa与一定量O2完全反应生成Na2O和Na2O2时转移的电子数为3NA
C. 0.5L1mol·L-1的NaHS溶液中含有的HS-、S2-的总数为0.5NA
D. 2molNO和1molO2充分反应后,体系中含有的NO2分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物由C、H、O三种元素组成,分子中含有8个原子,1mol该有机物含有46mol质子.完全燃烧该有机物在相同条件下测定CO2和水蒸气体积比为2:1.取2.7g该有机物恰好与30mL 1mol/L的碳酸钠溶液完全反应.(请写出必要的计算过程)求:
(1)有机物分子式;
(2)有机物结构简式.
(3)写出该有机物在一定条件下与乙二醇反应生成六元环状化合物的方程式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是()
A. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在,都不是酸性氧化物
B. N2+3H2![]() 2NH3、N2+O2
2NH3、N2+O2![]() 2NO都属于氮的固定,且N2都表现还原性
2NO都属于氮的固定,且N2都表现还原性
C. 向BaCl2溶液中加入Na2SO3产生沉淀,再通入NO2,沉淀完全溶解
D. 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定含有NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链状有机物M(分子式为C4H6O2)在催化剂作用下可与H2发生加成反应生成有机物N(分子式为C4H8O2),下列有关说法不正确的是(均不考虑立体异构)( )
A. 若M属于羧酸类有机物,则M的结构有3种
B. 若M属于酯类有机物,则M的结构有4种
C. 若M属于羧酸类有机物,则M的加成产物N的结构有2种
D. 若M属于酯类有机物,则M的加成产物N的结构有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA.下列说法正确的是( )
A. 1L0.1molL﹣1NH4Cl溶液中,NH4+的数量为0.1NA
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U,W,Y是原子序数依次增大的短周期主族元素,在周期表中的相对位置如右表;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
U | |||
W | Y |
(1)元素U的原子核外共有种不同能级的电子.
(2)能提高W与稀硫酸反应速率的方法是
a.使用浓硫酸 b.加热 c.加压 d.使用等质量的W粉末
(3)在恒容密闭容器中进行:2YO2(g)+O2(g) ![]() 2YO3(g)△H2=﹣190kJ/mol
2YO3(g)△H2=﹣190kJ/mol
①该反应 450℃时的平衡常数500℃时的平衡常数(填<,>或=).
②下列描述中能说明上述反应已达平衡的是
a.2ν(O2)正=ν(YO3)逆 b.气体的平均分子量不随时间而变化
c.反应时气体的密度不随时间而变化 d.反应时气体的分子总数不随时间而变化
③在一个固定容积为2L的密闭容器中充入0.20mol YO2和0.10molO2 , 半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=:平衡常数为 . 若继续通入0.20molYO2和0.10molO2 , 再次达到平衡后,YO3物质的量约为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com