
【题目】按下图装置进行实验,可证明碳和浓硫酸反应放出气体SO2和CO2。
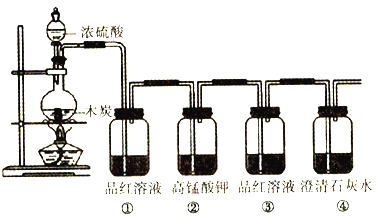
(1)木炭与浓H2SO4反应的化学方程式是_________________________________________,该反应的氧化剂为_______________,当转移2mol电子时,生成标准状况下的SO2和CO2共_______L。
(2)洗气瓶①、②中溶液褪色,体现二氧化硫的性质依次为_________(填序号)。
a.氧化性、还原性 b.漂白性、还原性 c.漂白性、氧化性 d.还原性、漂白性
(3)证明二氧化碳存在的现象为_______________________________________________。
【答案】 C+2H2O4(浓)![]() CO2↑+2SO2↑+2H2O 浓H2SO4 33.6 b 洗气瓶③中品红溶液不再褪色,澄清石灰水变浑浊
CO2↑+2SO2↑+2H2O 浓H2SO4 33.6 b 洗气瓶③中品红溶液不再褪色,澄清石灰水变浑浊
【解析】(1). 木炭与浓H2SO4反应生成CO2、SO2和H2O,化学方程式为:C+2H2O4(浓)![]() CO2↑+2SO2↑+2H2O,在该反应中,C元素的化合价升高,S元素的化合价降低,所以氧化剂是浓H2SO4,由反应方程式可知,每消耗1molC,转移电子4mol,生成1molCO2和2molSO2,所以转移2mol电子时,生成0.5molCO2和1molSO2,在标准状况下的体积为:(0.5+1)mol×22.4L/mol=33.6L,故答案为:C+2H2O4(浓)
CO2↑+2SO2↑+2H2O,在该反应中,C元素的化合价升高,S元素的化合价降低,所以氧化剂是浓H2SO4,由反应方程式可知,每消耗1molC,转移电子4mol,生成1molCO2和2molSO2,所以转移2mol电子时,生成0.5molCO2和1molSO2,在标准状况下的体积为:(0.5+1)mol×22.4L/mol=33.6L,故答案为:C+2H2O4(浓)![]() CO2↑+2SO2↑+2H2O;浓H2SO4;33.6;
CO2↑+2SO2↑+2H2O;浓H2SO4;33.6;
(2). 洗气瓶①中品红溶液褪色,体现了二氧化硫的漂白性,②中高锰酸钾溶液褪色,体现了二氧化硫的还原性,故答案选b;
(3). 当洗气瓶③中品红溶液不再褪色,证明SO2已被除尽,澄清石灰水变浑浊,即可证明有二氧化碳存在,故答案为:洗气瓶③中品红溶液不再褪色,澄清石灰水变浑浊。


科目:高中化学 来源: 题型:
【题目】实验是进行化学研究的重要手段之一。请回答下列问题:
(1)实验室需要450 mL 1 mol·L-1硫酸溶液。
①配制1 mol·L-1的硫酸时,下列仪器肯定不需要的是_________(填标号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有________________。
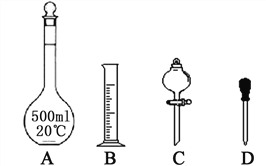
②在容量瓶的使用方法中,下列操作正确的是_______(填写序号)。
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制硫酸溶液时,用量筒量取浓硫酸后用玻璃棒引流注入容量瓶中,然后加水。
(2)如图装置中,若A中盛有品红溶液,B中盛有氢氧化钠溶液。
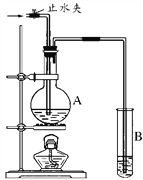
①向A中通入足量的SO2气体,然后加热,A中的现象_____________。
②向A中通入足量的Cl2气体,然后加热,A中的现象是_____________。
③若将SO2和Cl2按1:1体积比(同温同压)同时通入A中,则溶液不褪色。原因是SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是______________________。
(3)若(2)中的A中盛的是浓硫酸,加入足量的锌后,关闭止水夹并加热,进入B溶液的气体的化学式为____________;B中发生反应的离子方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磁性流体材料广泛应用于减震、医疗器械、声音调节等高科技领域。下图是制备纳米Fe3O4磁流体的两种流程:

(1)分析流程图中的两种流程,其中______(填“流程1”、“流程2”)所有反应不涉及氧化还原反应。步骤①反应的离子方程式为____________。
(2)步骤②保持50℃ 的方法是_____________。
(3)步骤③中加入的H2O2电子式是_______,步骤③制备Fe3O4磁流体的化学方程式为_______。
(4)流程2中FeCl3和FeCl2制备Fe3O4磁流体,理论上FeCl3和FeCl2物质的量之比为_____。己知沉淀B为四氧化三铁.步骤⑤中操作a具体的步骤是____________。
(5)利用K2Cr2O7可测定Fe3O4磁流体中的Fe2+含量。若Fe3O4磁流体与K2Cr2O7充分反应消耗了0.01mol·L -1的K2Cr2O7标准溶液100mL,则磁流体中含有Fe2+的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系。
(1)若A为金属铝,B为氧化铁,该反应的一种用途是_______________。
(2)若A是一种能使紫色石蕊试液变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,该反应的化学反应方程式为____________________________。
(3)若A是淡黄色粉末,常用作供氧剂,C为强碱,则该反应的离子反应方程式为__________。
(4)若A是一种酸式盐,可作为食品制作过程中的膨松剂,A、B、D溶于水时均呈碱性,则该反应的离子反应方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合径中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同物质的量的CO和N2,下列说法中:①它们所含原子个数相等;②它们所含分子数相等;③它们的质量相等。正确的有
A. ①② B. ①③ C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实:
(1)X+Y2+===X2++Y
(2)Z+2H2O![]() Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+离子的氧化性比X2+弱
(4)由Y、W作电极组成的原电池反应为:Y-2e-===Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是()
A. X>Y>Z>W B. Y>X>W>Z
C. Z>X>Y>W D. Z>Y>X>W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com