
����Ŀ��ij�л�����C��H��O����Ԫ����ɣ������к���8��ԭ�ӣ�1mol���л��ﺬ��46mol���ӣ���ȫȼ�ո��л�������ͬ�����²ⶨCO2��ˮ���������Ϊ2��1��ȡ2.7g���л���ǡ����30mL 1mol/L��̼������Һ��ȫ��Ӧ������д����Ҫ�ļ�����̣���
��1���л������ʽ��
��2���л���ṹ��ʽ��
��3��д�����л�����һ�����������Ҷ�����Ӧ������Ԫ��״������ķ���ʽ��
���𰸡�
��1���⣺����CO2��ˮ���������Ϊ2��1�ã�N��C����N��H��=1��1��
������л���ķ���ʽΪCxHxOy��x��1��y��1��2x+y=8����
��x=1��y=6��������������46�����������⣬
��x=2��y=4����������=6��2+1��2+8��4=46���������⣮
������л���ķ���ʽΪC2H2O4��
���л������ʽΪC2H2O4��
��2���⣺���л������Է�������Ϊ90��
2.7g���л�������ʵ���Ϊ0.03mol��̼���Ƶ����ʵ���Ϊ0.03mol��
����л��ﺬ�����Ȼ����ṹ��ʽHOOC��COOH��
���л���Ľṹ��ʽΪ��HOOC��COOH��
��3���⣺���л�����һ�����������Ҷ�����Ӧ������Ԫ��״������ķ���ʽΪHOOC��COOH+HOH2C��CH2OH ![]()
 +2H2O��
+2H2O��
������������ͬ�����²�ò���CO2�����ˮ�����������Ϊ2��1���л���A��̼ԭ������ԭ�����ʵ�����Ϊ2��1��2=1��1�� 2.7g���л���ǡ����30mL 1mol/L��̼������Һ��ȫ��Ӧ������л����к����Ȼ�������2��COOH��Na2CO3��ϵʽ��֪���Ȼ������ʵ����͵���̼�����Ƶ����ʵ�����2����Ȼ�����۳�A��Ħ����������д�ɷ���ʽ�ͽṹ��ʽ���Դ˽����⣮


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д� ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D����ѧ��ѧ�������ʣ�������һ����������A+B��C+D��ת����ϵ��
��1����AΪ��������BΪ���������÷�Ӧ��һ����;��_______________��
��2����A��һ����ʹ��ɫʯ����Һ���������壬�Ҹ÷�Ӧ�ǹ�ҵ����ȡ�������Ҫ��Ӧ֮һ���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ____________________________��
��3����A�ǵ���ɫ��ĩ����������������CΪǿ���÷�Ӧ�����ӷ�Ӧ����ʽΪ__________��
��4����A��һ����ʽ�Σ�����ΪʳƷ���������е����ɼ���A��B��D����ˮʱ���ʼ�������÷�Ӧ�����ӷ�Ӧ����ʽΪ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӻ�������Ʊ�1��4�����������������������й������йص�8����Ӧ���������������ﶼ����ȥ���� 
��1�������١���8������������ȡ����Ӧ����������ţ���ͬ����������ȥ��Ӧ���������ڼӳɷ�Ӧ���� ��
��2��д���������ʵĽṹ��ʽ��
B �� C �� D ��
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��
�� ��
�� ��
�� ��
�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ҵ�����Ϳ�����������Ҫ����;����ش��������⣺
��1����̬ Ni ԭ���У���������������ߵ��ܼ�����Ϊ_________���۲���ӵĹ������ʽΪ_________��
��2��Ni�����������ṹ��ͼ��ʾ��
A B
��A ���ۡ��е����B��ԭ��Ϊ_________��
��A���庬�л�ѧ��������Ϊ___________����ѡ����ĸ����
A������ B������ C����� D��������
��A������Nԭ�ӵ��ӻ���ʽ��_________��
��3�� �˹��ϳɵ��黯�������ڸ���ȱ�ݣ�ijȱ���黯�������ΪNi1.2As�� ���� Ni Ԫ��ֻ�У�2 �ͣ�3 ���ּ�̬�� ���ּ�̬����������Ŀ֮��Ϊ_________��
��4�� NiAs�ľ����ṹ��ͼ��ʾ��

�������ӵ���λ��Ϊ_________��
���������ӵ�������ֵΪNA�������ܶ�Ϊ �� g��cm��3����þ����������������֮��ľ���Ϊ_________pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Mg��AgCl�����һ���Ժ�ˮΪ�������Һ��ˮ�����أ���������������ǣ�������
A.������ӦʽΪMg��2e��=Mg2+
B.������ӦʽΪAg++e��=Ag
C.��طŵ�ʱCl����������Ǩ��
D.�����ᷢ������ӦMg+2H2O=Mg��OH��2+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ����ʵ��
��1��X��Y2��===X2����Y
��2��Z��2H2O![]() Z(OH)2��H2��
Z(OH)2��H2��
��3��Z2�����ӵ������Ա�X2����
��4����Y��W���缫��ɵ�ԭ��ط�ӦΪ��Y��2e��===Y2��
�ɴ˿�֪��X��Y��Z��W�Ļ�ԭ����ǿ������˳���ǣ���
A. X��Y��Z��W B. Y��X��W��Z
C. Z��X��Y��W D. Z��Y��X��W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.25 mol Na2SO4�У����е���ԭ�Ӹ���ԼΪ
A.1B.0.25
C.6.02��1023D.3.01��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ6NO2��8NH3===7N2��12H2O���ɵ�ص�װ����ͼ��ʾ���˷�������ʵ����Ч�������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܡ�����˵����ȷ���ǣ���

A. ���������缫�������غ������Ҳ�缫
B. Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C. �缫A����ӦʽΪ2NH3��6e��===N2��6H��
D. ����4.48 L NO2������ʱ��ת�Ƶ�����Ϊ0.8NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں�����������ʼʱ�ݻ���Ϊ5L�ļס������ܱ������У���Ϊ������������Ϊ��ѹ�������������з�Ӧ��N2��g��+3H2��g��2NH3��g����H2=��92.4kJ/mol���й����ݼ��ض�ƽ��״̬������
���� | ��ʼͶ�� | ��ƽ��ʱ | |||
�� | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
�� | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
��1����ƽ���ͬ�����ʵ����������ͬ����ʼʱ������ͨ���N2�����ʵ���Ϊ ��
��ʼʱ���е�ѹǿ�Ǽ������������ҵ�ƽ�ⳣ��Ϊ
��2�������ܱ������п��Է��������ķֽⷴӦ����ƽ����ı��±��з�Ӧ����x�����и�����y��x����������������ѡ����ţ���
ѡ�� | a | b | c | d |
x | �¶� | �¶� | ����H2�����ʵ��� | ���백�������ʵ��� |
y | ��������ƽ����Է������� | ƽ�ⳣ��K | ���������ܶ� | ��ƽ��ʱ������ת���� |
��3���о���������������ʱ���ı���ʼ�����������ʵ����Է�Ӧ��Ӱ�죬ʵ������ͼ��ʾ��ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������
������T2��T1�Ĺ�ϵ�ǣ�T2T1������ڡ������ڡ������ڡ�����ȷ��������
��a��b��c�����У�N2ת������ߵ���������ĸ����
���������ݻ�Ϊ1L��T2������ʼ��ϵ�м���1mol N2 �� 3molH2 �� ����5min��Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����NH3�ķ�Ӧ����Ϊ �� ��������������䣬����ʼʱ�������ڷ���2mol N2��6mol H2 �� ��ƽ���ų�������ΪQ����Q110.88kJ�����������������=������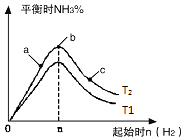
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com