
����Ŀ���ں�����������ʼʱ�ݻ���Ϊ5L�ļס������ܱ������У���Ϊ������������Ϊ��ѹ�������������з�Ӧ��N2��g��+3H2��g��2NH3��g����H2=��92.4kJ/mol���й����ݼ��ض�ƽ��״̬������
���� | ��ʼͶ�� | ��ƽ��ʱ | |||
�� | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
�� | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
��1����ƽ���ͬ�����ʵ����������ͬ����ʼʱ������ͨ���N2�����ʵ���Ϊ ��
��ʼʱ���е�ѹǿ�Ǽ������������ҵ�ƽ�ⳣ��Ϊ
��2�������ܱ������п��Է��������ķֽⷴӦ����ƽ����ı��±��з�Ӧ����x�����и�����y��x����������������ѡ����ţ���
ѡ�� | a | b | c | d |
x | �¶� | �¶� | ����H2�����ʵ��� | ���백�������ʵ��� |
y | ��������ƽ����Է������� | ƽ�ⳣ��K | ���������ܶ� | ��ƽ��ʱ������ת���� |
��3���о���������������ʱ���ı���ʼ�����������ʵ����Է�Ӧ��Ӱ�죬ʵ������ͼ��ʾ��ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������
������T2��T1�Ĺ�ϵ�ǣ�T2T1������ڡ������ڡ������ڡ�����ȷ��������
��a��b��c�����У�N2ת������ߵ���������ĸ����
���������ݻ�Ϊ1L��T2������ʼ��ϵ�м���1mol N2 �� 3molH2 �� ����5min��Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����NH3�ķ�Ӧ����Ϊ �� ��������������䣬����ʼʱ�������ڷ���2mol N2��6mol H2 �� ��ƽ���ų�������ΪQ����Q110.88kJ�����������������=������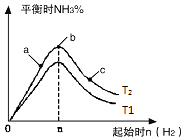
���𰸡�
��1��1.6mol��0.8��107��mol/L����2
��2��bc
��3�����ڣ�c��0.24mol��L��1 �� min��1����
���������⣺��1���ס�������ʵ����ͬ�����ʵ����������ͬ��˵���ﵽ��ͬ��ƽ��״̬�����������V�� ![]() =
= ![]() ��V=4L����������ʽ���ף�N2+3H22NH3 ��
��V=4L����������ʽ���ף�N2+3H22NH3 ��
��ʼ�� 2 3 0
�仯�� 0.75 2.25 1.5
ƽ���� 1.25 0.75 1.5
�ң�N2+3H22NH3 ��
��ʼ�� a b 0
�仯�� 0.6 1.8 1.2
ƽ���� a��0.6 b��1.8 1.2![]() =
= ![]() ����a=1.6mol��
����a=1.6mol�� ![]() =
= ![]() ����b=2.4mol����ʼʱ�������е�ѹǿ�Ǽ������ı���Ϊ��
����b=2.4mol����ʼʱ�������е�ѹǿ�Ǽ������ı���Ϊ�� ![]() =0.8���ҵ�ƽ�ⳣ��k=
=0.8���ҵ�ƽ�ⳣ��k= ![]() =107��mol/L����2
=107��mol/L����2
���Դ��ǣ�1.6mol�� 0.8�� 107��mol/L����2��2��a���÷�Ӧ�����ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ���������������ʵ���������������������䣬ƽ����Է���������С����a����
b��ƽ�ⳣ��ֻ���¶��йأ��¶ȸı�ƽ�ⳣ���ı䣬�����¶�ƽ��������Ӧ�����ƶ���ƽ�ⳣ������b��ȷ��
c�������������������������������������䣬��������ܶ�����c��ȷ��
d�����백����ƽ��������Ӧ�����ƶ�������ת���ʼ�С����d����
���Դ��ǣ�bc����3����Ϊ��ӦΪ���ȷ�Ӧ���¶�����ѧƽ���������ȷ�����У���T1��T2�����ﰱ���������ӣ�ƽ�����ƣ���T2��T1��
���Դ��ǣ����ڣ���b�����ƽ��״̬��c���ּ�������������ƽ�������ƶ���������ת��������
���Դ��ǣ�c���ۻ�ѧƽ������ʽ������ʽ���㣬
N2��g��+3H2��g��2NH3��g��
��ʼ����mol��1 3 0
�仯����mol��0.6 3��60% 1.2
ƽ������mol�� 0.4 1.2 1.2
��Ӧ����v= ![]() =0.24mol��L��1 �� min��1����ʱ��Ӧ�ų�����=92.4kJ/mol��
=0.24mol��L��1 �� min��1����ʱ��Ӧ�ų�����=92.4kJ/mol�� ![]() =55.44KJ�����ƽ�����H2��ת����Ϊ60%ʱ�ų�������������ʼʱ�������ڷ���2mol N2��6mol H2 �� �൱������ѹǿƽ��������У���Ӧ�ǿ��淴Ӧ���ܽ��г��ף��ų�����С��2��92.4kJ/mol=184.8KJ������H2��ת����Ϊ60%ʱ�ų���������2������������55.44KJ��2=110.88kJ��
=55.44KJ�����ƽ�����H2��ת����Ϊ60%ʱ�ų�������������ʼʱ�������ڷ���2mol N2��6mol H2 �� �൱������ѹǿƽ��������У���Ӧ�ǿ��淴Ӧ���ܽ��г��ף��ų�����С��2��92.4kJ/mol=184.8KJ������H2��ת����Ϊ60%ʱ�ų���������2������������55.44KJ��2=110.88kJ��
���Դ��ǣ�0.24mol��L��1 �� min��1������
�����㾫�������û�ѧƽ��ļ������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����C��H��O����Ԫ����ɣ������к���8��ԭ�ӣ�1mol���л��ﺬ��46mol���ӣ���ȫȼ�ո��л�������ͬ�����²ⶨCO2��ˮ���������Ϊ2��1��ȡ2.7g���л���ǡ����30mL 1mol/L��̼������Һ��ȫ��Ӧ������д����Ҫ�ļ�����̣���
��1���л������ʽ��
��2���л���ṹ��ʽ��
��3��д�����л�����һ�����������Ҷ�����Ӧ������Ԫ��״������ķ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ��ǣ� ��
A. ����ˮ���ռ�ͭ����Ũ���ᷴӦ������NO2
B. �ð�ˮ����NaCl��MgCl2��A1C13��NH4C1������Һ
C. ������KMnO4��Һ��֤����Ļ�ԭ��
D. �����Ȼ�粒����Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���淴Ӧ��A��g��+3B��g��2C��g������H��0���м��������ݻ�Ϊ0.5L���ܱ���������������м���1molA�ĺ�3molB��һ�������´ﵽƽ��ʱ�ų�����ΪQ1kJ������ͬ�����£����������м���2molC�ﵽƽ��ʱ��������ΪQ2kJ����֪Q2=3Q1 �� ����������ȷ���ǣ� ��
A.���е��Ȼ�ѧ����ʽΪ2C��g��A��g��+3B��g������H=+4Q2/3kJ/mol
B.��Ӧ�ﵽƽ��ǰ������ʼ����v������v�� �� ����ʼ����v������v��
C.�ڸ������£���Ӧ2C��g��A��g��+3B��g����ƽ�ⳣ��Ϊ9��1.52��mol/L��2
D.����C��ת����Ϊ25%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���絼���Ǻ����������Һ����������С��������������Һ�絼�ʱ仯����ȷ���ζ���Ӧ���յ㡣��ͼ��ijͬѧ��0.1mol/L KOH ��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1mol/L��HCl��CH3COOH ��Һ�ζ�����ʾ��ͼ(�����Һ����仯���Բ���)�������й��жϲ���ȷ����
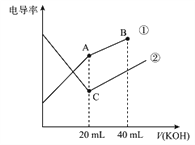
A. ����������0.1mol/L KOH ��Һ�ζ�CH3COOH��Һ�ĵζ����ߣ���������0.1mol/LKOH ��Һ�ζ�HCl��Һ�ĵζ�����
B. ����ͬ�¶��£�C��ˮ�����c (H+) ����A��ˮ�����c(H+)
C. ��A �����Һ������ c(CH3COO-)+c(OH-)-c (H+)=0.05mol/L
D. ��B �����Һ������ c(K+)>c(OH-)>c(CH3COO-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��U��W��Y��ԭ��������������Ķ���������Ԫ�أ������ڱ��е����λ�����ұ���UԪ������Ԫ�����γ�������ɫ���壻W�ǵؿ��к������Ľ���Ԫ�أ�
U | |||
W | Y |
��1��Ԫ��U��ԭ�Ӻ�����ֲ�ͬ�ܼ��ĵ��ӣ�
��2�������W��ϡ���ᷴӦ���ʵķ�����
a��ʹ��Ũ���� b������ c����ѹ d��ʹ�õ�������W��ĩ
��3���ں����ܱ������н��У�2YO2��g��+O2��g�� ![]() 2YO3��g����H2=��190kJ/mol
2YO3��g����H2=��190kJ/mol
�ٸ÷�Ӧ 450��ʱ��ƽ�ⳣ��500��ʱ��ƽ�ⳣ�����������=����
��������������˵��������Ӧ�Ѵ�ƽ�����
a��2�ͣ�O2����=�ͣ�YO3���� b�������ƽ������������ʱ����仯
c����Ӧʱ������ܶȲ���ʱ����仯 d����Ӧʱ����ķ�����������ʱ����仯
����һ���̶��ݻ�Ϊ2L���ܱ������г���0.20mol YO2��0.10molO2 �� ����Ӻ�ﵽƽ�⣬��������к�YO30.18mol����ͣ�O2��=��ƽ�ⳣ��Ϊ �� ������ͨ��0.20molYO2��0.10molO2 �� �ٴδﵽƽ���YO3���ʵ���ԼΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Fe3O4)����ɿɱ�ʾΪFe2O3��FeO������˵������ȷ����(����)
A.������������һ�ֻ����B.������������һ�ִ�����
C.�����������й̶�����ɺͽṹD.������������һ�ֺ�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.CH4��C4H10��һ����ͬϵ��
B.�������мȺ���̼̼�������ֺ���̼̼˫��
C.��ϩʹ��ˮ��ɫ����ȡ����Ӧ
D.����ʱ������һ��ƺʹ���ʹ��ζ��ɿڣ�ԭ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£��������������С��������
A.������Ӽ��ƽ������B.������ӵ�������С
C.������ӵ���ĿD.������ӵ���Ŀ��������ӵ�������С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com