
【题目】四氧化三铁(Fe3O4)的组成可表示为Fe2O3·FeO,下列说法不正确的是( )
A.四氧化三铁是一种混合物B.四氧化三铁是一种纯净物
C.四氧化三铁有固定的组成和结构D.四氧化三铁是一种黑色固体
科目:高中化学 来源: 题型:
【题目】下列有关各实验的叙述中正确的是 ( )



A. ①利用CCl4密度大于乙醇,进行CCl4与乙醇混合物的分离
B. ②进行H2、NH3、CO2、Cl2、NO、NO2等气体的收集
C. ③当X选用苯时可进行NH3或HCl的吸收,并防止倒吸
D. ④可用于NH3的干燥,收集并吸收多余NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)2NH3(g)△H2=﹣92.4kJ/mol,有关数据及特定平衡状态见表.
容器 | 起始投入 | 达平衡时 | |||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为 ,
起始时乙中的压强是甲容器的倍,乙的平衡常数为
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是(选填序号).
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影响,实验结果如图所示(图中T表示温度,n表示物质的量):
①像中T2和T1的关系是:T2T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2 , 3molH2 , 经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为 . 保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2 , 达平衡后放出的热量为Q,则Q110.88kJ(填“>”、“<”或“=”).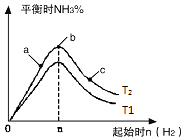
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知I-、Fe2+、SO2和Cl-均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I->Fe2+>Cl-,下列反应不可能发生的是( )
A. Cl2+SO2+2H2O=H2SO4+2HCl B. 2Cl-+2Fe3+=2Fe2++Cl2↑
C. 2Fe3++2I-=2Fe2++I2 D. 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:①CO(g)+ ![]() O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
②H2(g)+ ![]() O2 (g)=H2O(g);△H=﹣241.8kJmol﹣1则下列说法正确的是( )
O2 (g)=H2O(g);△H=﹣241.8kJmol﹣1则下列说法正确的是( )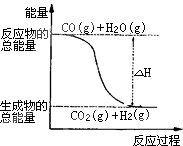
A.H2的燃烧热为241.8kJmol﹣1
B.由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.2 kJmol﹣1
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g)+ ![]() O2 (g)=H2O(l);△H>﹣241.8 kJmol﹣1
O2 (g)=H2O(l);△H>﹣241.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫酸钾、硫酸铝和硫酸组成的混合溶液中,c(H+)=0.2molL-1,c(Al3+)=0.4molL-1,c(SO42-)=0.8molL-1,则c(K+)为( )
A. 0.2molL-1 B. 0.3molL-1 C. 0.4molL-1 D. 0.5molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com