
【题目】Mg﹣AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )
A.负极反应式为Mg﹣2e﹣=Mg2+
B.正极反应式为Ag++e﹣=Ag
C.电池放电时Cl﹣由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】I 现有下列十种物质:①Na2O ②Cu(OH)2 ③Zn ④CaCO3 ⑤硫酸溶液 ⑥Ba(OH)2 ⑦干冰 ⑧NH3 ⑨盐酸 ⑩KHSO4
(1)其中属于电解质的有_____________(填序号)。
(2)往②中加入过量的0.1 mol/L⑩的水溶液,发生反应的离子方程式是___________,向所得溶液中继续加入③,会产生无色气泡,该反应的离子方程式是_____________________。
II 右图是某仪器的一部分,数字XY之间相差 1ml, 若是量筒的一部分且X=5,则所盛液体的体积是_______;若是滴定管的一部分且X=15,则凹液面的读数应该是_______。

III 在新疆和甘肃的交界处有一条山谷,被称为“魔鬼谷”,其地表浅处有一层磁铁矿,经常是晴天霹雳,雷雨倾盆;但树草却异常旺盛,其原因是雨水中含有一种能促进植物生长的离子是_________,当雨水浸到地表与磁铁矿接触时发生反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A. 往Na2SiO3溶液中加入盐酸:2Na++ SiO32- +2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
B. 氯气与烧碱溶液反应:Cl2+2OH-![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
C. 稀硫酸滴在铁片上:Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
D. 铜片插入硝酸银溶液中:Cu+Ag+![]() Cu2++Ag
Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. NaHSO4水溶液能使石蕊变红,但NaHSO4不是酸
B. 有单质参加或有单质生成的反应一定是氧化还原反应
C. 酸性氧化物一定是非金属氧化物
D. 1molCl2的体积是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物由C、H、O三种元素组成,分子中含有8个原子,1mol该有机物含有46mol质子.完全燃烧该有机物在相同条件下测定CO2和水蒸气体积比为2:1.取2.7g该有机物恰好与30mL 1mol/L的碳酸钠溶液完全反应.(请写出必要的计算过程)求:
(1)有机物分子式;
(2)有机物结构简式.
(3)写出该有机物在一定条件下与乙二醇反应生成六元环状化合物的方程式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
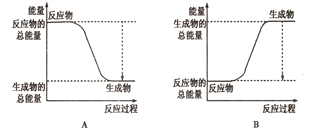
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时![]() (N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
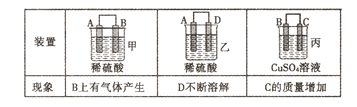
①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是( )
A.苯(甲苯)KMnO4(酸化),NaOH溶液分液
B.乙烷(乙烯)酸性KMnO4(溶液洗气
C.乙酸乙酯(乙酸)KOH溶液分液
D.苯(苯酚)浓Br2水过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。下图是某同学用0.1mol/L KOH 溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH 溶液滴定曲线示意图(混合溶液体积变化忽略不计)。下列有关判断不正确的是
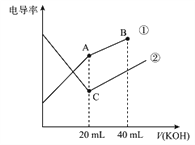
A. 曲线①代表0.1mol/L KOH 溶液滴定CH3COOH溶液的滴定曲线,曲线②代0.1mol/LKOH 溶液滴定HCl溶液的滴定曲线
B. 在相同温度下,C点水电离的c (H+) 大于A点水电离的c(H+)
C. 在A 点的溶液中有: c(CH3COO-)+c(OH-)-c (H+)=0.05mol/L
D. 在B 点的溶液中有: c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com