
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
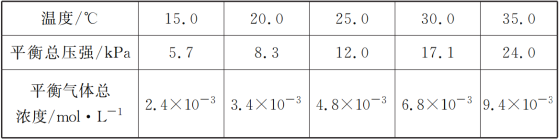
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),实验测得的不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得的不同温度下的平衡数据列于下表:
①可以判断该分解反应已经达到平衡的是___________
A. 2v(NH3)=v(CO2)
B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时氨基甲酸铵的分解平衡常数表达式为________;平衡常数为________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_______ (填“增加”“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH________0(填“>”“=”或“<”),熵变ΔS______0(填“>”“=”或“<”)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。
NH4HCO3+NH3·H2O。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
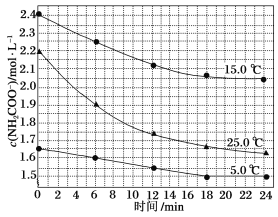
⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:_______
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25.0 ℃时反应物的起始浓度较小,但0~6 min的平均反应速率(曲线的斜率)仍比15.0 ℃时的________(填“大”或“小”)。
【答案】BC K=c2(NH3)·c(CO2) 1.6×10-8(molL-1)3 增加 > > 0.05mol·L-1·min-1 大
【解析】
(1)①根据化学平衡状态的特征分析判断;②根据化学平衡常数的表达式进行计算;③根据压强对平衡的影响分析判断;④根据温度对化学平衡移动的影响以及反应前后气体量的变化来确定焓变和熵变的符号;
(2)⑤根据化学反应速率的公式v=![]() 计算;⑥根据图像曲线的斜率判断。
计算;⑥根据图像曲线的斜率判断。
(1)①A、各物质的反应速率等于其化学计量数之比,该等量关系在任何时候都不成立,无法判断是否为平衡状态,故A错误;
B、由于反应前后气体的化学计量数之和不相等,容器中气体的压强不变,说明达到了平衡状态,故B正确;
C、由于反应物是固体,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,说明达到了平衡状态,故C正确;
D、根据方程式,氨气的体积分数始终为![]() 不变,氨气的体积分数不变,不能说明达到平衡状态,故D错误;
不变,氨气的体积分数不变,不能说明达到平衡状态,故D错误;
故选BC;
②根据反应:NH2COONH4(s)2NH3(g)+CO2(g),n(NH3)=2n(CO2),所以c(CO2)=![]() ×4.8×10-3molL-1=1.6×10-3molL-1,c(NH3)=
×4.8×10-3molL-1=1.6×10-3molL-1,c(NH3)=![]() ×4.8×10-3molL-1=3.2×10-3molL-1,依据平衡常数的表达式K= c2(NH3) c(CO2),25.0℃时氨基甲酸铵的分解平衡常数为:K=1.6×10-3molL-1×(3.2×10-3molL-1)2=1.6×10-8(molL-1)3,故答案为:K=c2(NH3) c(CO2);1.6×10-8(molL-1)3;
×4.8×10-3molL-1=3.2×10-3molL-1,依据平衡常数的表达式K= c2(NH3) c(CO2),25.0℃时氨基甲酸铵的分解平衡常数为:K=1.6×10-3molL-1×(3.2×10-3molL-1)2=1.6×10-8(molL-1)3,故答案为:K=c2(NH3) c(CO2);1.6×10-8(molL-1)3;
③压缩容器体积,增大了压强,平衡向着逆向移动,氨基甲酸铵固体的质量增加,故答案为:增加;
④根据表中的数据温度越高,则平衡气体的总浓度越大,所以升高温度,平衡正向移动,说明正反应是吸热反应,反应物是固体,产物是气体,该反应是熵增加的过程,即△H>0,△S>0,故答案为:>;>;
(2)⑤化学反应速率v=![]() =
=![]() =0.05mol/(Lmin),故答案为:0.05mol/(Lmin);
=0.05mol/(Lmin),故答案为:0.05mol/(Lmin);
⑥根据图像,尽管25℃反应物起始浓度较小,但温度高于15℃,使得0~6min的平均反应速率(曲线的斜率)仍比15℃大,故答案为:大。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】(1)①写出二氧化碳的电子式:________________;
②写出赤铁矿石主要成份的化学式:___________________。
③写出氨分子的结构式:__________________。
(2)写出镁在二氧化碳中燃烧的化学方程式__________________________________________________。
(3)写出铜与氯化铁溶液反应的离子方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
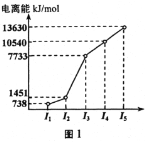
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有___种不同运动状态的电子。
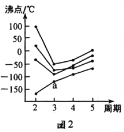
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___。
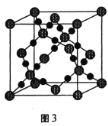
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于___晶体。
(4)第一电离能介于Al、P之间的第三周期元素有___种。GaCl3原子的杂化方式为___。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有___个紧邻分子。D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是___(填字母标号)。
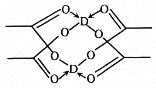
a.极性键 b.非极性键 c.配位键 d.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值,下列说法正确的是
A.1mol OH﹣含有的电子数为9NA
B.标准状况下,NO2和N2O4的混合物23g中含有NA个氧原子
C.常温常压下,2.8gN2和2.24L CO所含电子数均为1.4NA
D.标准状况下,22.4 L 乙醇中含有NA个乙醇分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中Ca2+、Mg2+、SO42-。提纯的操作步骤和加入试剂的情况如图:
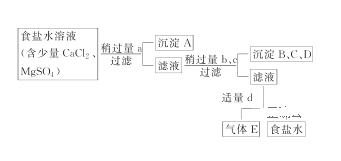
图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)沉淀A的名称是________。
(2)试剂d是________;判断试剂d已经足量的方法是___________________。
加入适量d后溶液中发生反应的离子方程式为___________________________。
(3)现有下列仪器,过滤出沉淀A、B、C、D时必须用到________(填序号),仪器③的名称是________。
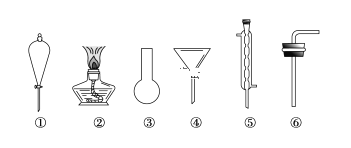
Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是________(填序号)。
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的________(填序号),该仪器名称为________,向该碘水中加入四氯化碳以提取碘单质的实验操作为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是重要的化学反应,在人类的生产和生活中无处不在。
(1)已知反应:BaSO4+C——BaS+CO↑
①配平该反应___。
②若有2.33gBaSO4发生反应,则反应过程中转移电子的数目是__,标准状况下,生成一氧化碳___L。
(2)已知反应:Cu+HNO3(稀)——Cu(NO3)2+NO↑+H2O;
①配平并用“双线桥法”表示上述反应中电子转移的方向和数目___。
②该反应中氧化剂与还原剂的物质的量之比为__;写出该反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)简单鉴别Fe(OH)3胶体和FeCl3溶液的方法是_______________。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请用双线桥表示出电子转移的方向和数目_____________________
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则可检出待测液中含有的金属阳离子是_____;
②验证该溶液中含有Fe2+,正确的实验方法是_______(用字母代号填)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
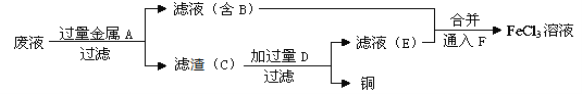
①滤渣C的主要成分的化学式为_______、_______。
②加过量D发生反应的离子方程式为__________________________________。
③通入F发生反应的化学方程式为 ___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com