
【题目】(1)①写出二氧化碳的电子式:________________;
②写出赤铁矿石主要成份的化学式:___________________。
③写出氨分子的结构式:__________________。
(2)写出镁在二氧化碳中燃烧的化学方程式__________________________________________________。
(3)写出铜与氯化铁溶液反应的离子方程式:________________________________________________。
【答案】![]() Fe2O3
Fe2O3 ![]() 2Mg + CO2
2Mg + CO2 ![]() 2MgO + C Cu + 2Fe3+ = Cu2+ + 2Fe2+
2MgO + C Cu + 2Fe3+ = Cu2+ + 2Fe2+
【解析】
(1)电子式根据原子之间形成的共用电子对分析;
(2)赤铁矿为氧化铁。
(3)氨气分子含有三个氮氢键,据此书写结构式;
(4)根据镁和二氧化碳反应生成氧化镁和碳书写方程式;
(5)根据铜和氯化铁反应生成氯化铜和氯化亚铁书写离子方程式。
(1).二氧化碳的电子式为 ![]() ;
;
(2)赤铁矿为氧化铁,化学式为 Fe2O3 ;
(3)氨气分子中含有三个氮氢键,故结构式为 ![]() ;
;
(4)镁和二氧化碳反应生成氧化镁和碳,方程式为:2Mg + CO2 ![]() 2MgO + C;
2MgO + C;
(5)铜和氯化铁反应生成氯化亚铁和氯化铜,离子方程式为: Cu + 2Fe3+ = Cu2+ + 2Fe2+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以CO2和H2为原料制取乙醇的反应为 2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下 的密闭容器中,按CO2和H2的物质的量比为 1∶3 投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示。下列说法正确的是
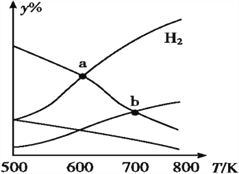
A. a点的平衡常数小于b点 B. b点:v正(CO2)=v逆(H2O)
C. a点:n(H2)=n(H2O) D. 温度不变,充入更多H2,v(CO2)始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.将铜片插入稀硝酸中:![]()
B.稀硫酸与Ba(OH)2溶液反应:![]()
C.向A12(SO4)3溶液中加入过量氨水:![]()
D.向Na2SiO3溶液中滴加醋酸:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A和B,随着反应的进行,各物质的物质的量浓度变化如图所示。下列说法不正确的是
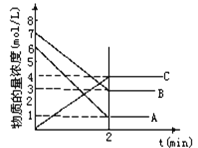
A.该反应的化学方程式为:5A+4B![]() 4C
4C
B.该反应达到平衡时,A、B、C的浓度比为5∶4∶4
C.用B的浓度变化表示2min内的速率为2 mol·L-1·min-1
D.2 min前,正反应速率逐渐减小,逆反应速率逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
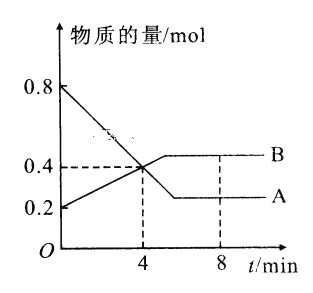
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
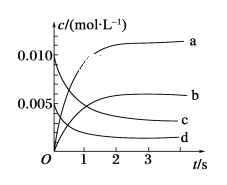
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是( )
H+ + O22-)下列分析不正确的是( )

A.①、⑤中产生的气体能使带火星的木条复燃
B.①、④中均发生了氧化还原反应和复分解反应
C.②、⑤中KMnO4与MnO2的作用不同
D.通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)![]() G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
温度℃ | 25 | 80 | 230 |
平衡常数值 | 5×104 | 2 | 1.9× 10﹣5 |
A.上述反应是熵增反应
B.25℃时,反应G(g)![]() E(s)+4F(g)的平衡常数值是0.5
E(s)+4F(g)的平衡常数值是0.5
C.在80℃时,测得某时刻,F、G浓度均为0.5 mol·L﹣1,则此时v(正)>v(逆)
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 酸性溶液中KIO3与KI反应生成I2:IO![]() +I-+6H+===I2+3H2O
+I-+6H+===I2+3H2O
B. 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-===2BaSO4↓+Al(OH)3↓
C. 用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2===2NH4++SO32-+H2O
D. 用铜作电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),实验测得的不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得的不同温度下的平衡数据列于下表:
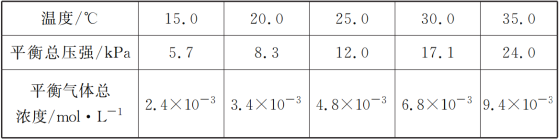
①可以判断该分解反应已经达到平衡的是___________
A. 2v(NH3)=v(CO2)
B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时氨基甲酸铵的分解平衡常数表达式为________;平衡常数为________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_______ (填“增加”“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH________0(填“>”“=”或“<”),熵变ΔS______0(填“>”“=”或“<”)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。
NH4HCO3+NH3·H2O。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
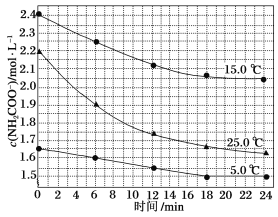
⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:_______
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25.0 ℃时反应物的起始浓度较小,但0~6 min的平均反应速率(曲线的斜率)仍比15.0 ℃时的________(填“大”或“小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com