
【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
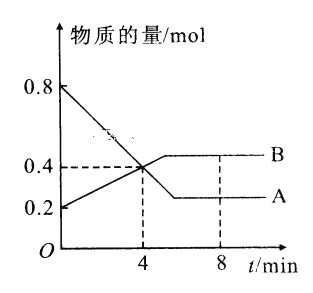
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
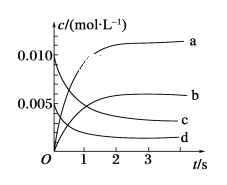
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
【答案】2AB 0.05mol·(L·min)-1 否 = 是 b bc
【解析】
由图象可知,A为反应物,B为生成物,当A和B的物质的量保持不变时,反应达到平衡状态。由II 的表中数据可知,NO的物质的量在第3min后保持不变,达到平衡状态。
I.(1)由图象可知,在4min时,A和B的变化量分别为0.4mol和0.2mol,变化量之比为2:1,故该反应的化学方程式为2AB。
(2)反应开始时至4min时,A的平均反应速率为![]() 0.05mol·(L·min)-1。
0.05mol·(L·min)-1。
(3)4min时,反应没有达平衡状态,因为此后反应物和生成物的量仍在变化中。由图象中信息可知, 8min时,A和B的量保持不变,故反应处于平衡状态,故V正=V逆。
II.(1) 由II 的表中数据可知,NO的物质的量在第3min后保持不变,达到平衡状态。因此,上述反应是可逆反应。
(2)前3min,NO的浓度的变化量为![]() 0.0065mol/L,则该段时间内NO2的浓度的变化量也是0.0065mol/L,因此,结合图中信息可知,表示NO2变化曲线的是b。
0.0065mol/L,则该段时间内NO2的浓度的变化量也是0.0065mol/L,因此,结合图中信息可知,表示NO2变化曲线的是b。
(3) a. v(NO2) =2v(O2) ,不能表示正反应速率等于逆反应速率,不能说明该反应已达到平衡状态;
b. 反应前后的气体分子数不同,故当容器内压强保持不变时,能说明该反应已达到平衡状态;
c. v逆(NO)=2v正(O2) ,表示正反应速率等于逆反应速率,故能说明该反应已达到平衡状态;
d. 反应过程中容器内的气体的质量和体积一直保持不变,故当容器内密度保持不变时,不能说明该反应已达到平衡状态。
综上所述,能说明该反应已达到平衡状态的是bc。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】有一种可做融雪剂的盐,其主要成分的化学式为XY2 , X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54mol电子。
(1)该融雪剂的化学式是_________;用电子式表示XY2的形成过程__________________。
(2)主族元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻, 则D的离子结构示意图是_________;D与E能形成一种类似于CO2的三原子分子,且每个原子均达到了8e稳定结构,该分子的化学键类型为_________(填“离子键”或“共价键”)。
(3)用化学式回答:
①D与Y的氢化物稳定性________>________;
②D与Y的最高价氧化物对应水化物酸性________>________。
(4)某兴趣小组设计的简易原电池装置如下图所示。回答下列问题:

①锌片为_____极(填“正”或“负”)。
②电池正极的现象是_________________,其电极反应式为_____________________。
③电流由_______经导线流向______(填“锌片”或“碳棒”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
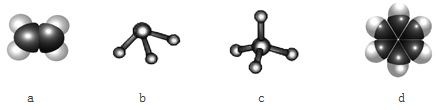
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
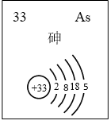
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
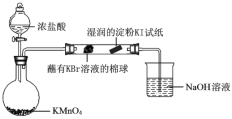
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构式为:___________________________________。
(2)写出下列化合物官能团的名称:
B中含官能团名称________________;
D中含官能团名称________________。
(3)写出反应的化学方程式及反应类型:
①乙烯→B__________________;反应类型:________。
②B→C__________________;反应类型:________。
③B+D→乙酸乙酯_________________;反应类型:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_________(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_________________,Q2+的未成对电子数是______。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4
①铜元素在周期表中的位置是________________,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_____________________。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_______(填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是________,写出一种与SO42-互为等电子体的分子的化学式:__________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示,则该化合物的化学式为_________。若该晶体的密度为 ρ g·cm-3,则该晶体内铜离子与氧离子间的最近距离为_____________(用含 ρ 的代数式表示,其中阿伏加德罗常数用NA表示)cm。
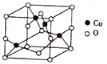
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com